
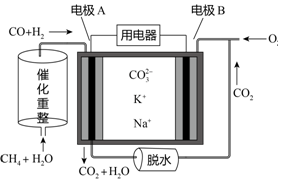
| A. | 电极A上H2和CO都发生了氧化反应 | |
| B. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| C. | 电池工作时,电能转变为化学能 | |
| D. | 电极B上发生的电极反应为:O2+2H2O+4e-═4OH- |
分析 甲烷和水经催化重整生成CO和H2,反应中C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32-,以此解答该题.
解答 解:A.负极电极A反应为H2+CO+2CO32--4e-=H2O+3CO2,H2和CO都发生了氧化反应,故A正确;
B.反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,故B错误;
C.电池工作时,化学能转变为电能,故C错误;
D.B为正极,正极为氧气得电子生成CO32-,反应为O2+2CO2+4e-=2CO32-,故D错误;
故选A.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 不能判断溶液中是否存在SO42- | B. | 溶液中一定不存在的离子是CO32 | ||
| C. | 不能判断溶液中是否存在Ag+ | D. | 不能判断是否含有[Al(OH)]4-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用CaO和浓氨水快速制取氨气 | |
| B. | FeCl3溶液中加Fe粉,颜色由棕黄色变为浅绿色 | |
| C. | 新制氯水放置一段时间颜色变浅 | |
| D. | 工业上在高压条件下制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 含不溶性杂质的粗苯甲酸进行重结晶分离的操作步骤之一是趁热过滤 | |
| C. | 做银镜反应实验后,用硝酸洗涤试管壁上的银镜 | |
| D. | 制备乙酸乙酯时,先向大试管中加入浓硫酸,再逐滴加入乙醇和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y形成的具有10e-的分子中含非极性共价键 | |
| B. | X单质和Z单质在暗处剧烈反应形成的化合物比HCl稳定 | |
| C. | 含W元素的盐溶液一定显酸性 | |
| D. | Z离子半径小于W离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉与Fe2O3高温下反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | NaOH与H2SO4的中和反应 | D. | 灼热的炭与CO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑦⑧ | B. | ①③④⑤ | C. | ①③④⑤⑦ | D. | ①④⑤⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,乙烯通入溴水中,现象是溴水褪色,这一反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br,白酒的主要成分的化学名称是乙醇,乙酸的结构简式:CH3COOH,醇的官能团名称是羟基,羧酸的官能团名称是羧基,羧酸和醇二者在一定条件下发生反应的类型是酯化反应(或取代反应);苯的空间结构为平面正六边型结构,常温下为液态.
,乙烯通入溴水中,现象是溴水褪色,这一反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br,白酒的主要成分的化学名称是乙醇,乙酸的结构简式:CH3COOH,醇的官能团名称是羟基,羧酸的官能团名称是羧基,羧酸和醇二者在一定条件下发生反应的类型是酯化反应(或取代反应);苯的空间结构为平面正六边型结构,常温下为液态.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸被称为是化学工业的发动机,硫酸的年产量可以作为衡量一个国家无机化学工业发展水平的标志,为提高经济效益,人类生产活动尽可能多功能化,共生工程将会大大促进化学工业的发展.
硫酸被称为是化学工业的发动机,硫酸的年产量可以作为衡量一个国家无机化学工业发展水平的标志,为提高经济效益,人类生产活动尽可能多功能化,共生工程将会大大促进化学工业的发展.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com