
分析 (1)根据盖斯定律书写目标热化学方程式;
(2)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质;
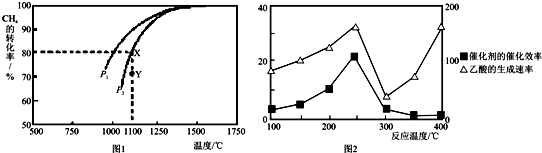
(3)该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;根据转化率计算平衡时各物质的平衡浓度,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到平衡常数;
(4)①催化剂活性越大,反应速率越大,温度过高,催化剂的活性降低;
②为了提高该反应中的CH4转化率,可以使平衡正向移动.
解答 解:(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,②+③-①得:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-203kJ•mol-1,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-203kJ•mol-1;
(2)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质,则一定条件下向NH4HS溶液中通入空气,得到单质硫和氨水,则反应方程式为:2NH4HS+O2=2NH3•H2O+2S↓,
故答案为:2NH4HS+O2=2NH3•H2O+2S↓;
(3)该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2,压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
在Y点对应温度下的甲烷的平衡转化率为80%,则
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始(mol/L) 0.1 0.1 0 0
转化(mol/L)0.08 0.08 0.16 0.16
平衡(mol/L)0.02 0.02 0.16 0.16
所以平衡常数K=$\frac{0.1{6}^{2}×0.1{6}^{2}}{0.02×0.02}$=1.6;
故答案为:小于;大于;1.6;
(4)①由于250℃是Cu2Al2O4催化剂的活性温度,所以在250℃时催化剂活性最大,反应速率大,温度250~300℃时,催化剂的活性降低,使催化效率下降,
故答案为:温度高于250℃时,催化剂的活性降低,使催化效率下降;
②平衡正向移动,CH4转化率增大,增大CO2的浓度或及时分离出乙酸,平衡正向移动,
故答案为:增大CO2的浓度;及时分离出乙酸.
点评 本题考查了化学平衡常数的计算、盖斯定律的应用、平衡的移动等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:多选题
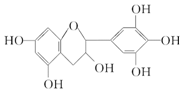
| A. | 分子式为C15H16O7 | |
| B. | 1 mol儿茶素A在一定条件下最多能与6 mol H2加成 | |
| C. | 等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应消耗金属钠和氢氧化钠的物质的量之比为1:1 | |
| D. | 1 mol儿茶素A与足量的浓溴水反应,最多消耗Br2 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、AlO2-、NO3- | B. | K+、Na+、HSO3-、Cl- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Fe3+、Na+、ClO-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | V1=20mL,V2>20mL | |
| B. | A点之后至B点之前的溶液中,一定是:c(X- )>c( Na+)>c(H+)>c(OH- ) | |
| C. | 若V1=10mL,C点的溶液中,一定是:c(HY )-c( Y-)=2[c(OH- )-c(H+)] | |
| D. | D点以后的溶液中,一定是:c( Na+)>c(OH- )>c(Y- )>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
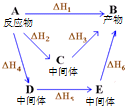
| A. | 组成为C4H8的化合物性质都相同 | |
| B. | 氢弹原料D、T,可由${\;}_1^1$H在化学反应中制取 | |
| C. | 粗铜电解精炼时,阳极减少的质量一定等于阴极增加的质量 | |
| D. | 图中物质A经不同途径生成B时,焓变满足:△H1=△H2+△H3=△H4+△H5+△H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
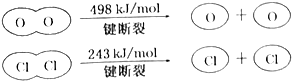
| A. | 反应A的△H>-115.6kJ•mol-1 | |
| B. | H2O中H-O键比HCl中H-Cl键弱 | |
| C. | 由II中的数据判断氯元素的非金属性比氧元素强 | |
| D. | 断开1molH-O键与断开1molH-Cl键所需能量相差31.9kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com