
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为Br.
;元素⑩名称为Br.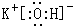 .
.分析 根据元素在周期表中的相对位置可知:①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K,⑩是Br,根据金属性和非金属性的递变规律判断元素的金属性和非金属性强弱,以此比较单质或化合物的性质,并判断化合物的种类.
(1)稀有气体化学性质稳定;根据原子核外电子的排布规律来画结构示意图;
(2)同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性增强、金属性减弱,非金属性越强,最高价含氧酸的酸性越强,金属性越强,最高价氧化物的水化物的碱性越强;
(3)元素⑤与⑦形成化合物的化学式为AlCl3;
(4)相对分子质量越大,分子间作用力越强,沸点越高,③的气态氢化物为水,含有氢键,沸点较高;
(5)电子层数越多离子半径越大,电子层结构相同,核电荷数越大离子半径越小.
解答 解:根据元素在周期表中的分布可知,①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K,⑩是Br,
(1)在这些元素中,化学性质最不活泼的是稀有气体Ar,其原子结构示意图为: ,⑩是Br,
,⑩是Br,
故答案为:Ar; ;Br;
;Br;
(2)同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性增强、金属性减弱,故第三周期中Cl元素非金属性最强,第四周期K的金属性最强,故HClO4的酸性最强,KOH碱性最强,其电子式为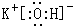 ,故答案为:HClO4;
,故答案为:HClO4;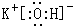 ;
;
(3)Cl与Al形成化合物的化学式AlCl3,在液态或固态时不导电,则由分子构成,它属于共价化合物,故答案为:AlCl3;共价;
(4)相对分子质量越大,分子间作用力越强,沸点越高,H2O含有氢键,沸点最高,HCl、H2S不含氢键,故答案为:H2O;H2O分子间含有氢键;
(5))③、⑥、⑦三种元素形成的离子分别为O2-、S2-、Cl-,O2-电子层数最少,半径最小,S2-和Cl-电子层数相同,Cl-核电荷数大,半径小,离子半径由大到小的顺序是S2->Cl->O2-,故答案为:S2->Cl->O2-.
点评 本题考查元素周期表与元素周期律的关系,题目难度不大,注意电子式的书写,结合元素周期律来分析解答,注意氯化铝是共价化合物,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 蒸馏自来水可得到蒸馏水 | B. | 酸溶法除去Al2O3的Fe2O3 | ||
| C. | 过滤法除去乙酸中的乙醇 | D. | 碱溶法除去Al2O3中的SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol•L-1•s-1 | B. | v(A2)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(B2)=0.42 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气质量日报的主要目的是树立人们环保意识,同时也让人们知道了二氧化硫、二氧化氮和可吸入颗粒物是大气主要污染物 | |
| B. | 酸雨是指pH小于7的雨水 | |
| C. | 为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须进行回收处理 | |
| D. | 食品厂产生的含丰富氮、磷营养素的废水不可以长期排向水库 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH3OH | CH3OCH3 | H2O |
| t1 | 0.8 | 1.24 | 1.24 |
| t2 | 0.08 | 1.6 | 1.6 |
| A. | 平衡后升高温度,平衡常数>400 | |
| B. | t2时刻反应达到平衡状态 | |
| C. | 平衡时,反应混合物的总能量减少20kJ | |
| D. | 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HI>HBr>HCl>HF | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:Cl-<Br-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com