
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.1 mol K2Cr2O7被还原为Cr3+转移的电子数为3NA
B.合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.1 L 0.1 mol·L-1磷酸钠溶液含有离子的数目为0.1NA
D.常温常压下,18.4 g NO2和N2O4的混合气体中含有的氮原子总数为0.4NA
科目:高中化学 来源: 题型:
【题目】在容积不变的绝热密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列不能说明该反应达到化学平衡状态的是
2NH3(g) △H<0。下列不能说明该反应达到化学平衡状态的是
A.混合气体的密度不变B.体系温度不变
C.3v逆(NH3)=2v正(H2)D.N2和NH3的浓度的比值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列有关叙述正确的是
A.在 12.0g NaHSO4 晶体中,所含离子数目为 0.3NA
B.足量的镁与浓硫酸充分反应,放出 2.24L 混合气体时,转移电子数为 0.2NA
C.30g 冰醋酸和葡萄糖的混合物中含氢原子的数目为 2NA
D.标准状况下,11.2L 乙烯和丙烯混合物中含氢原子数目为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。
(1)砷(As)在元素周期表中的位置为____________________,磷的基态原子的价电子排布式为__________,六种元素中电负性最大的是__________(填元素符号)。
(2)N2分子中σ键和π键的数目比N(σ): N(π)=__________。NH3的分子构型为__________,中心原子的杂化方式为__________。
(3)热稳定性:NH3_____PH3(填“>”或“<”),沸点:N2H4______P2H4(填“>”或“<”)。
(4)已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷)ΔH=-17.6kJ·mol-1
由此推知,其中最稳定的磷单质是__________。
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,因此配制SbCl3溶液应加入__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图所示),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
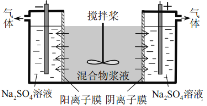
用惰性电极电解时,CrO42-能从浆液中分离出来的原因是_________________________,分离后含铬元素的粒子是__________,阴极室生成的物质为__________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生反应:C6H12O6+6O2![]() 6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
A. 该生物燃料电池不可以在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C. 消耗1 mol氧气时转移4 mol e-,H+向负极移动
D. 今后的研究方向是设法提高葡萄糖生物燃料电池的效率,从而使其在将来可以为任何可植入医疗设备提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)是具有强还原性的弱酸,可以被银离子氧化为磷酸。1摩尔亚磷酸最多消耗2摩尔氢氧化钠。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________。
(2)Na2HPO3是____(填“正盐”或“酸式盐”) 。
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________。
(4)某温度下,0.10 molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2 molL-1,该温度下H3PO3的电离平衡常数K1=___________________;(结果保留两位有效数字)。
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(![]() )在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
A. 甲醛分子间可以形成氢键B. 甲醛分子和甲醇分子内C原子均采取sp2杂化。
C. 甲醛为极性分子D. 甲醇的沸点远低于甲醛的沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com