
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂的作用下转化为单质S。已知:
①CO(g)+0.5O2(g)![]() CO2(g) ΔH=-283.0kJ·mol-1
CO2(g) ΔH=-283.0kJ·mol-1
②S(s)+O2(g)![]() SO2(g) ΔH=-296.0kJ·mol-1
SO2(g) ΔH=-296.0kJ·mol-1
则处理CO、SO2的方法的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)![]() NO(g)+CO2(g) ΔH=-a kJ·mol-1 (a>0)
NO(g)+CO2(g) ΔH=-a kJ·mol-1 (a>0)
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为______mol,放出的热量为_____(用含有a和b的代数式表示)kJ。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=_______。
(4)已知下列热化学方程式:
①H2(g)+0.5O2(g)![]() H2O(l) △H=-285.8 kJ·mol-1
H2O(l) △H=-285.8 kJ·mol-1
②H2(g)+0.5O2(g)![]() H2O(g) △H=-241.8 kJ·mol-1
H2O(g) △H=-241.8 kJ·mol-1
则H2的燃烧热(△H)为________________________。
【答案】2CO(g)+SO2(g)![]() S(s)+2CO2(g) ΔH=-270 kJ·mol-1 0.3 3(2a+b)/80 -1160 kJ·mol-1 -285.8 kJ·mol-1
S(s)+2CO2(g) ΔH=-270 kJ·mol-1 0.3 3(2a+b)/80 -1160 kJ·mol-1 -285.8 kJ·mol-1
【解析】
(1). 根据盖斯定律将所给的热化学方程式合并可得所求的热化学方程式;
(2). 根据盖斯定律求出4CO(g)+2NO2(g)![]() N2(g)+4CO2(g)的反应热,反应中标准状况下3.36LCO即0.15molCO反应时转移0.3mol电子,根据物质的量之比等于热量比求出放出的热量;
N2(g)+4CO2(g)的反应热,反应中标准状况下3.36LCO即0.15molCO反应时转移0.3mol电子,根据物质的量之比等于热量比求出放出的热量;
(3). 根据盖斯定律将已知方程式合并得2CH4(g)+4NO2(g)![]() 2N2(g)+2CO2(g)+4H2O(g) △H=△H1+△H2,结合1molCH4还原NO2至N2的整个过程中放出的热量为867kJ计算;
2N2(g)+2CO2(g)+4H2O(g) △H=△H1+△H2,结合1molCH4还原NO2至N2的整个过程中放出的热量为867kJ计算;
(4). 根据燃烧热指的是1mol纯净物完全燃烧生成稳定氧化物放出的热量分析。
(1). 已知:①CO(g)+0.5O2(g)![]() CO2(g) ΔH=-283.0kJ·mol-1
CO2(g) ΔH=-283.0kJ·mol-1
②S(s)+O2(g)![]() SO2(g) ΔH=-296.0kJ·mol-1
SO2(g) ΔH=-296.0kJ·mol-1
将方程式①×2②得2CO(g)+SO2(g)![]() S(s)+2CO2(g) △H=(283.0kJmol1)×2(296.0 kJmol1)=270 kJmol1,所以处理CO、SO2的热化学反应方程式为:2CO(g)+SO2(g)
S(s)+2CO2(g) △H=(283.0kJmol1)×2(296.0 kJmol1)=270 kJmol1,所以处理CO、SO2的热化学反应方程式为:2CO(g)+SO2(g)![]() S(s)+2CO2(g) ΔH=-270 kJ·mol-1,故答案为:2CO(g)+SO2(g)
S(s)+2CO2(g) ΔH=-270 kJ·mol-1,故答案为:2CO(g)+SO2(g)![]() S(s)+2CO2(g) ΔH=-270 kJ·mol-1;
S(s)+2CO2(g) ΔH=-270 kJ·mol-1;
(2). 已知:①CO(g)+NO2(g)![]() NO(g)+CO2(g) ΔH=-a kJ·mol-1 (a>0)
NO(g)+CO2(g) ΔH=-a kJ·mol-1 (a>0)
②2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
将方程式①×2+②得4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H=(-a)kJmol-1×2+(-b kJmol-1)=-(2a+b)kJmol-1,所以其热化学反应方程式为:4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=-(2a+b)kJmol-1,根据方程式可知转移电子的物质的量为:
N2(g)+4CO2(g) △H=(-a)kJmol-1×2+(-b kJmol-1)=-(2a+b)kJmol-1,所以其热化学反应方程式为:4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=-(2a+b)kJmol-1,根据方程式可知转移电子的物质的量为:![]() ×2=0.3mol,放出的热量为:
×2=0.3mol,放出的热量为:![]() ×
×![]() =
=![]() kJ,故答案为:0.3;3(2a+b)/80;
kJ,故答案为:0.3;3(2a+b)/80;
(3). 已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
将方程式①+②得2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g) △H=△H1+△H2,根据方程式可知,1mol CH4还原NO2至N2整个过程中放出的热量为867kJ,所以△H2=-867 kJ·mol-1×2-(-574 kJ·mol-1)=-1160 kJ·mol-1,故答案为:-1160 kJ·mol-1;
(4). 燃烧热指的是1mol纯净物完全燃烧生成稳定氧化物放出的热量,则反应①H2(g)+0.5O2(g)![]() H2O(l) △H=-285.8 kJ·mol-1是表示氢气燃烧热的热化学方程式,所以氢气的燃烧热为△H=-285.8 kJ·mol-1,故答案为:-285.8 kJ·mol-1。
H2O(l) △H=-285.8 kJ·mol-1是表示氢气燃烧热的热化学方程式,所以氢气的燃烧热为△H=-285.8 kJ·mol-1,故答案为:-285.8 kJ·mol-1。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】如图是CO2生产甲醇的能量变化示意图.下列说法正确的是
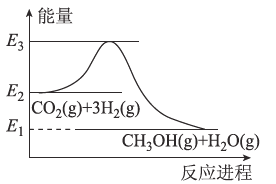
A. E2-E1是该反应的热效应
B. E3-E1是该反应的热效应
C. 实现变废为宝,且有效控制温室效应
D. 该反应放热,在常温常压下就能进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验实验室配制500mL 0.1molL-1的碳酸钠溶液,请回答下列问题.
(1)应用托盘天平称取Na2CO310H2O晶体__________g.
(2)配置碳酸钠溶液时,需要的主要玻璃仪器除烧杯和胶头滴管以外还需要_________、____________.
(3)配置过程中,若遇到以下操作可能造成实验结果偏大,偏小还是不影响?
①容量瓶中原来有少量蒸馏水_____
②定容时,俯视液面_____
③有少量氢氧化钠溶液残留在烧杯中_____
④盖好瓶塞反复摇匀,发现液面低于标线,再加蒸馏水使液面达到刻度处_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图的装置中,干燥烧瓶中盛有某种气体,烧杯和胶头滴管内盛装某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是

A.CO2(饱和NaHCO3溶液)无色喷泉
B.NO2(H2O含石蕊)红色喷泉
C.NH3(H2O含石蕊)蓝色喷泉
D.HCl(AgNO3溶液)白色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏碘滴定法可测量中药材中二氧化硫是否超标(亚硫酸盐折算成二氧化硫)。原理是利用如图装置将亚硫酸盐转化为SO2,然后通过碘标准溶液滴定吸收液。

实验步骤如下:
I.SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300 mL; 锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液; 打开冷凝水,通氮气,滴入盐酸10mL; 加热烧瓶A并保持微沸约3min后,用0.01000mol/L 碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL;
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL.
(1)仪器C的名称______。仪器B的入水口为_______(填“a”或“b”)。
(2)滴入盐酸前先通氮气一段时间作用是________,测定过程中氮气的流速过快会导致测量结果______。(填“偏大”“偏小”“不变”)
(3)①滴定过程中使用的滴定管为_________。
A.酸式无色滴定管 B.酸式棕色滴定管 C.碱式无色滴定管 D.碱式棕色滴定管
②滴定时锥形瓶中反应的离子方程式为________,滴定终点的现象是________。
(4)空白实验的目的是________。
(5)该中药中含SO2含量为________mg/ kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g)+O2(g) ![]() 2SO3(g)在一容积为2L的密闭容器中进行,试回答:
2SO3(g)在一容积为2L的密闭容器中进行,试回答:
(1)若要加快该反应的反应速率,可采取的措施有____________________、___________________。
(2)开始时,SO2的浓度是2mol/L,O2的浓度是4mol/L,2min内,SO2的浓度减少0.8mol/L,则v(SO2)=_____________。在2min末,SO3的浓度是_______________,O2的浓度是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设C(s)+CO2(g)===2CO(g) ΔH>0,反应速率为v1;N2(g)+3H2(g)===2NH3(g) ΔH<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
A. 同时增大B. 同时减小C. v1增大,v2减D. v1减小,v2增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com