
����Ŀ���������ȼҵ����Ҫ��Ʒ֮һ������ǿ�������������л����������з�Ӧ���ɶ����Ȼ��ij��ȤС����ʵ�����ж����·�Ӧ������̽�����ش��������⣺
�����Ȼ���(BCl3)���Ʊ���

�������ϣ���֪����BCl3�ķе�Ϊ12.5 �棬�۵�Ϊ��107.3 �棻 ��2B��6HCl ![]() 2BCl3����3H2����
2BCl3����3H2����
��BCl3��ˮ�۲쵽�����İ�����
��1�����鷢��װ��A�������Ե�ʵ����巽����_____________________________________
��2���������������Ӹ�װ�õĽӿڣ�˳��Ϊ_______
a��( )��( )��( )��( )��( )��( )�� ( ) �� ( ) ��h��
��3��װ��D��������________________��װ��E��������___________________________��ʵ����������װ��C�����ܲ����ĺ����____________��
��4��BCl3��ˮ��Ӧ�Ļ�ѧ����ʽΪ��_____________________________��
��SO2��Ư�۾���Һ�ķ�Ӧ
���� | ���� |
ȡ4g Ư�۾����壬����100mL ˮ����Ư�۾���Һ��pH | pH ��ֽ�ȱ�����ԼΪ12��������ɫ |
| 1.Һ���Ϸ����ְ����� 2.�Ժ��ֻ��ǣ���Һ��Ϊ����ɫ�� 3.�Ժ���������ɫ����������ɫ��ȥ |
��5��pH��ֽ��ɫ�ı仯˵��Ư�۾���Һ���е�������_____________________________��
��6������2����Һ��Ϊ����ɫ��ԭ���ǣ�����Һ���Ե���ǿ��Ư�۾�����Ч�ɷֺ�Cl- ������Ӧ���÷�Ӧ�����ӷ���ʽΪ________________________��
��7�������ӷ���ʽ��������3�л���ɫ��ȥ��ԭ��_______________________��
���𰸡� �õ��ɼм�סa�����رշ�Һ©���Ļ��������Һ©���м�������ˮ��Ȼ���Һ©���Ļ������۲쵽ˮ���������������Σ�˵������������ e d j k b c(��cb) f g Һ��BCl3ʹ��ӻ�������з������ �������ȷ���Ⱦ�������ҷ�������ˮ��������D�� B��HCl��Ӧ����H2��H2��Cl2������ȷ�����ը BCl3��3H2O��3HCl��H3BO3 ���ԡ�Ư���� ClO��+Cl��+2H+=2H2O+Cl2�� SO2+Cl2+2H2O+Ca2+=CaSO4��+2Cl-+4H+(��SO2+Cl2+2H2O=SO42-+2Cl-+4H+)
�����������ڼ��������£��������̺�Ũ���ᷢ��������ԭ��Ӧ����Cl2����Ũ������лӷ��ԣ�ˮ������Ҳ�������������¶ȼӿ��Ȼ����ˮ�����ӷ����������ɵ�Cl2�к���HCl��H2O��Ũ���������ˮ�ԣ�����ʳ��ˮ������Cl2��Ũ�����ܸ������壬�Ӷ��õ��ϴ�����Cl2����B���Ƶ�BCl3��Ȼ����D�õ�BCl3���壬Ϊ��ֹC�е�ˮ��������Dװ��ʹ���ɵ�BCl3ˮ�⣬F��װŨ������и��E����δ��Ӧ��Cl2��
(1)���鷢��װ��A�������Ե�ʵ����巽�����õ��ɼм�סa�����رշ�Һ©���Ļ��������Һ©���м�������ˮ��Ȼ���Һ©���Ļ������۲쵽ˮ���������������Σ�˵�����������ã��ʴ�Ϊ���õ��ɼм�סa�����رշ�Һ©���Ļ��������Һ©���м�������ˮ��Ȼ���Һ©���Ļ������۲쵽ˮ���������������Σ�˵�����������ã�
(2)Ϊ���Ʊ�BCl3�����ݵ�ԭ����3Cl2+2B![]() 2BCl3������װ�����ӵ�˳��Ӧ��Ϊ���巢��װ��---����װ��--��Ӧװ��--�ռ�װ��--β������װ�õ�˳����ʵ�����Ʊ������м������Ȼ����ˮ����Ӧ�ȳ�ȥHCl�ٳ�ȥˮ���������������Ӹ�װ�õĽӿڣ�˳��Ϊa��e��d��j��k��b��c��f��g��h���ʴ�Ϊ�� e d j k b c(��cb) f g��
2BCl3������װ�����ӵ�˳��Ӧ��Ϊ���巢��װ��---����װ��--��Ӧװ��--�ռ�װ��--β������װ�õ�˳����ʵ�����Ʊ������м������Ȼ����ˮ����Ӧ�ȳ�ȥHCl�ٳ�ȥˮ���������������Ӹ�װ�õĽӿڣ�˳��Ϊa��e��d��j��k��b��c��f��g��h���ʴ�Ϊ�� e d j k b c(��cb) f g��
(3)���Ȼ���ķе�ͣ��ӷ�����Ҫ��ȴ��Ʒ��װ��D����Һ��BCl3ʹ��ӻ�������з��������װ��E��һ��ʢ�м�ʯ�ҵĸ���ܣ�������һ����������δ��Ӧ�Ķ�����������һ������Ҳ��ֹ�����е�ˮ��������U�ιܣ�Cװ��������Cl2�л��е�HCl�����������֪�������Ȼ��ⷴӦ���ɵIJ����������������������������Ļ�����壬������ը���ʴ�Ϊ����ȴ���ռ����Ȼ���������Ȼ��ⷴӦ���ɵIJ����������������������������Ļ�����壬������ը���ʴ�Ϊ��Һ��BCl3ʹ��ӻ�������з���������������ȷ���Ⱦ�������ҷ�������ˮ��������D�У�B��HCl��Ӧ����H2��H2��Cl2������ȷ�����ը��
(4)�����������������ƣ�����Ļ�ѧʽΪH3BO3����������(H3AlO3)�������Ȼ�����ˮ�ܷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ��BCl3+3H2O=H3BO3+3HCl�����ʴ�Ϊ��BCl3+3H2O=H3BO3+3HCl����
����(5)pH��ֽ�ȱ���(ԼΪ12)��˵����Һ�ʼ��ԣ�����ɫ��ȥ��˵���־���Ư���ԣ��ʴ�Ϊ�����ԣ�Ư���ԣ�
(6)Ư�۾�����Ч�ɷ��Ǵ�����ƣ����������Cl- ����������ԭ��Ӧ������������Ӧ�����ӷ���ʽΪClO��+Cl��+2H+=2H2O+Cl2�����ʴ�Ϊ��ClO��+Cl��+2H+=2H2O+Cl2����
(7)��Һ�ʻ���ɫ����Cl2���ɣ�Cl2��SO2��Ӧ�������������ᣬ��Ӧ����ʽΪ��Cl2+SO2+2H2O=4H++2Cl-+SO42-�����������ˮ��Ҳ����д��SO2+Cl2+2H2O+Ca2+=CaSO4��+2Cl-+4H+���ʴ�Ϊ��Cl2+SO2+2H2O�T2Cl-+4H++SO42-(��SO2+Cl2+2H2O+Ca2+=CaSO4��+2Cl-+4H+)��


 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭп�Ͻ����ɫ���ƽ����ɫ�����Խ�����ͭп�Ͻ��Ƴɵļٽ�Ԫ����ƭ���˵��¼����з�����Ҫ���������ϵĽ������Ƿ�Ϊ���������𣬿�ȡ��Ʒ��һ���Լ����з�Ӧ�����������жϣ���ȡ���Լ��ǣ���ˮ��3��Ũ�����1��Ũ����Ļ����� ��
A.����B.����ˮ��C.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧ��������ʵ�飬��̽����ѧ��Ӧ�е������仯��
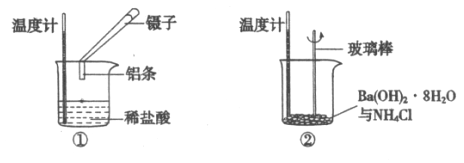
��1��ʵ����������е��¶Ƚ��ͣ��ɴ��ж����������������Ȼ�茶��巴Ӧ��____________������ȡ����ȡ�����Ӧ��
��2��ʵ����У���С��ͬѧ���ձ��м���5 mL 1.0 mol/L���ᣬ�ٷ�����ɰֽ��ĥ�����������۲����H2�����ʣ���ͼA��ʾ���÷�Ӧ��________������ȡ����ȡ�����Ӧ���������仯������ͼ�е�___________���B����C������ʾ��

A��0��t1�λ�ѧ��Ӧ���ʱ仯��ԭ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH=1��ij��ҺX�н�����NH4+��Al3+��Ba2+��Fe2+��Fe3+��CO32����SO32����SO42����Cl����NO3���е�һ�ֻ��֣�����ˮ�ĵ��뼰���ӵ�ˮ�⣩��ȡ����Һ��������ʵ�飬ʵ�������ͼ�������й��ƶϲ���ȷ���ǣ�������
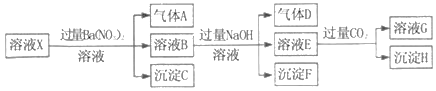
A. ��ҺX��һ������H+��Al3+��NH4+��Fe2+��SO42��
B. ������������ʵ�鲻��ȷ����ҺX���Ƿ���Fe3+��Cl��
C. ����HΪAl��OH��3��BaCO3�Ļ����
D. ����ҺXΪ100mL������������AΪ44.8mL����״��������X��c��Fe2+��=0.06molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��IUPAC����117��Ԫ��ΪTS��������![]() ��ti��n����TS��ԭ�Ӻ���������������7.����˵������ȷ���ǣ� ��
��ti��n����TS��ԭ�Ӻ���������������7.����˵������ȷ���ǣ� ��
A. TS�ǵ������ڵڢ�A��Ԫ�� B. TS��ͬλ��ԭ�Ӿ�����ͬ�ĵ�����
C. TS��ͬ��Ԫ���зǽ��������� D. ������Ϊ176��TS���ط�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����(����)
��![]() ��
��![]() �Dz�ͬ�ĺ��أ���˷ֱ���������ԭ�ӹ��ɵ�
�Dz�ͬ�ĺ��أ���˷ֱ���������ԭ�ӹ��ɵ�![]() 2��
2��![]() 2��ѧ���ʲ�ͬ��
2��ѧ���ʲ�ͬ��
��![]() 2��
2��![]() 2��
2��![]() 2��Ϊͬλ��,
2��Ϊͬλ��,![]()
��C60��12C��14C��Ϊͬλ�ء�
�ܿ�ѧ���ѷ�����H3���ӣ�H2��H3��Ϊͬ�������塡
��ϡ��Ԫ��![]() ��
��![]() ����������ͬ����������Ԫ�ء�
����������ͬ����������Ԫ�ء�
��H2O��D2O����ͬ��������
��![]() ��
��![]() ��������ͬ����Ϊͬλ��
��������ͬ����Ϊͬλ��
A. �ܢ� B. �ۢ� C. �ڢ� D. �ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͳ�ı�������������������� CCl2F2��й©��̨�ƻ������㣮�䷴Ӧ���̿ɱ�ʾΪ��O3����O+O2��Cl+O3��ClO+O2��ClO+O��Cl+O2 �� �ܷ�ӦΪ2O3��3O2 �� ������������������ķ�Ӧ�����У�Clԭ�ӵ������ǣ� ��
A.������
B.��ԭ��
C.����
D.�ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����Ϊ2 L���ܱ������У������·�����Ӧ��Fe(s)+CO2(g) ![]() FeO(s)+CO(g)������CO2��CO�����ʵ���(mol)��ʱ��(min)�ı仯��ϵ��ͼ��ʾ��
FeO(s)+CO(g)������CO2��CO�����ʵ���(mol)��ʱ��(min)�ı仯��ϵ��ͼ��ʾ��
��1����Ӧ��1 minʱ��һ�δﵽƽ��״̬�����������������3.2 g����CO2��Ũ�ȱ仯��ʾ�ķ�Ӧ����v(CO2)=��
��2����Ӧ������2 minʱ����ֻ�ı��¶ȣ����߷����ı仯��ͼ��ʾ��3 minʱ�ٴδﵽƽ�⣬��H0(�>����<����=��)��
��3��5 minʱ�ٳ���һ������CO(g)��ƽ�ⷢ���ƶ�������˵����ȷ����(��д���)��
A.v(��)��������С B.v(��)�ȼ�С������
C.v(��)��������С D.v(��)�ȼ�С������
��ʾn(CO2)�仯��������(��дͼ�����ߵ���ĸ���)��
��4�����ù�̬���ʵ��й���������˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ����HOOC��CHO�����л��ϳɵ���Ҫ�м��塣��ҵ������˫���ҳɶԵ�ⷨ��������ȩ�ᣬԭ����ͼ��ʾ����װ��������������Ϊ���Ե缫�������Ҿ��ɲ�����ȩ�ᣬ�����Ҷ�ȩ��M�缫�IJ��ﷴӦ������ȩ�ᡣ����˵������ȷ����

A��N�缫�ϵĵ缫��Ӧʽ��HOOC��COOH+2e��+2H+=HOOC��CHO+H2O
B������2 mol H+ ͨ�����ӽ���Ĥ����ȫ���뷴Ӧ�����װ�������ɵ���ȩ��Ϊ1 mol
C��M�缫�ϵĵ缫��ӦʽΪ��2Cl����2e��=Cl2��
D���Ҷ�ȩ��M�缫�IJ��ﷴӦ������ȩ��Ļ�ѧ����ʽ�� Cl2+OHC��CHO+ H2O = HOOC��CHO+2HCl
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com