
【题目】利用如图所示的装置收集以下气体:①H2,②Cl2,③O2,④HCl,⑤NO,⑥SO2,⑦NO2。
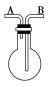
(1)若烧瓶是干燥的,则由B口进气,可收集的气体是________,若由A口进气,可收集的气体有________。
(2)若在烧瓶内充满水,可收集的气体有________,气体应由________口进入。
(3)若烧瓶中装入适量浓硫酸,可以用它来干燥的气体有________,气体应由________口进入。
科目:高中化学 来源: 题型:
【题目】以下是反应:2SO2+O2![]() 2SO3在不同条件下达到平衡状态时SO2的转化率。
2SO3在不同条件下达到平衡状态时SO2的转化率。
压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
试回答下列问题。
(1)关于可逆反应的限度,你能得出什么启示?
________________________________________。
(2)提高该化学反应限度的途径有:_____________________。
(3)要实现SO2的转化率为93.5%,需控制的反应条件是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1 mol/L NaOH溶液滴入20.00 mL 0.1 mol/L HA溶液,溶液pH随加入NaOH溶液体积的变化曲线如图所示。
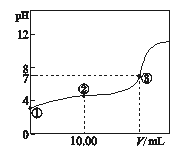
其中不正确的是 ( )
A. ①点:由水电离出的c(H+)=1×10-3mol/L
B. ②点:c(A-)>c(Na+)>c(H+)>c(OH-)
C. ③点:c(Na+)=c(A-)>c(H+)=c(OH-)
D. ③点加入NaOH溶液的体积小于20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如右图所示。据图判断正确的是
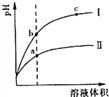
A. Ⅱ为盐酸稀释时的pH值变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移的方向和数目:_______________________________________。
(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面_______________________,则发生了钝化;若铁棒表面____________________,则未发生反应。
(3)用Na2SO3吸收法是治理SO2污染的一种方法,其原理为(用化学方程式表示): _______________________________________________________________。
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是_______________________(用离子方程式和必要的文字说明);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(![]() )由大到小的顺序为_______________;(填数字序号)
)由大到小的顺序为_______________;(填数字序号)
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈_____性,溶液中c(Na+)_____c(CH3COO-) (填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)向300mL1mol/L氢氧化钠溶液中通入4.48LCO2(标准状况),充分反应后,所得溶液中存在的物料守恒关系式为:_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检测熟肉中NaNO2含量,某兴趣小组从1 000 g 隔夜熟肉中提取NaNO3和NaNO2后配成溶液,用0.005 00 mol·L-1的高锰酸钾(酸性)溶液滴定。平行测定三次,求出每次NaNO2含量,取其平均值。(已知:2MnO![]() +5NO
+5NO![]() +6H+===2Mn2++5NO
+6H+===2Mn2++5NO![]() +3H2O)
+3H2O)
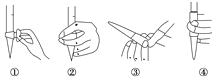
(1)滴定前排气泡时,应选择图中的________(填序号)。滴定时,高锰酸钾溶液盛放在___________________。
(2)滴定终点的判断依据为__________________________________。
(3)下列操作会导致样品含量测定值偏高的是__________________(填序号)。
a.锥形瓶用蒸馏水洗后未用待测液润洗
b.酸式滴定管用蒸馏水洗后未用标准液润洗
c.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
d.滴定前平视读数,滴定结束仰视读数
(4)某次滴定过程中,消耗高锰酸钾溶液的体积为16.00 mL。则此次求得的NaNO2的含量为________mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是MnO4-+NO2-+A―→Mn2++NO+H2O(未配平)。下列叙述中正确的是( )
A. 该反应中NO2-被还原
B. 反应过程中溶液的pH减小
C. 反应生成1 mol NO需消耗0.4 mol MnO4-
D. A是OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:
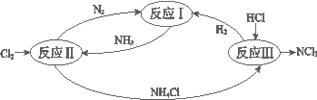
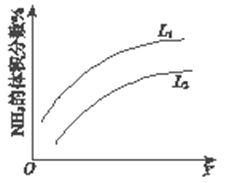
(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1。上图是反应I中平衡混合气中NH3的体积分数(V%)随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中横坐标X代表的是__________(填“温度”或“压强”),L1__________ L2(填“>”或“<”或“=”) 。
2NH3(g) ΔH=–92 kJmol-1。上图是反应I中平衡混合气中NH3的体积分数(V%)随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中横坐标X代表的是__________(填“温度”或“压强”),L1__________ L2(填“>”或“<”或“=”) 。
(2)反应II其中一步反应为2NH3(g)+3Cl2(g) =N2(g)+6HCl(g)ΔH=–462 kJmol-1
已知:![]() 断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
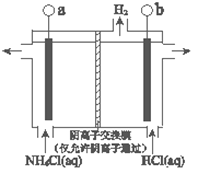
(3)反应III是利用下图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3+3H2↑。
NCl3+3H2↑。
①b接电源的_______(填“正”或“负”)。
②阳极反应式是_______。
(4)反应III得到的NCl3可以和NaClO2制备ClO2,同时生成NH3,该反应的离子方程式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com