
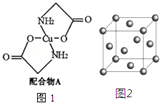
 已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示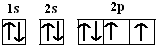 .
.分析 (1)根据同周期从左到右,元素的第一电离能呈增大趋势,但N元素原子的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻的元素;
(2)Cu是29号元素,其原子核外有29个电子,3d能级上有10个电子、4s能级上有1个电子,3d、4s能级上电子为其外围电子,根据构造原理书写其基态原子外围电子排布式;
(3)原子个数相等、价电子数相等的微粒为等电子体;
(4)氧为8号元素,核外有8个电子,根据原子构造原理画出氧原子的核外电子排布图;
(5)配合物A分子中一种碳有C=O,碳的杂化方式为sp2杂化,另一种碳周围都是单键,根据碳原子的成键情况要以判断碳原子的杂化方式;
(6)①利用均摊法确定晶胞中铜原子的个数
②铜晶胞的参数为a=x cm,则铜晶胞的体积为x3cm3,根据密度$ρ=\frac{m}{V}$计算.
解答 解:(1)同周期从左到右,元素的第一电离能呈增大趋势,但N元素原子的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻的元素,所以N、O的第一电离能大小关系为N>O;
故答案为:大于;N原子价电子排布为2s22p3,p能级半充满,原子稳定,第一电离能较高;
(2)Cu是29号元素,其原子核外有29个电子,3d能级上有10个电子、4s能级上有1个电子,3d、4s能级上电子为其外围电子,根据构造原理知其基态原子外围电子排布式为3d104s1,故答案为:3d104s1;
(3)一个二氧化碳分子中原子个数为3个,价电子数为16,原子个数相等、价电子数相等的微粒为等电子体,则CO2的等电子体为:N2O(或SCN-、N3-等),
故答案为:N2O(或SCN-、N3-等);
(4)氧为8号元素,核外有8个电子,氧原子的核外电子排布图为 ,
,
故答案为: ;
;
(5)配合物A分子中一种碳有C=O,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化;
故答案为:sp3、sp2;
(6)①利用均摊法知,晶胞中铜原子的个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,
故答案为:4;
②根据①知,铜晶胞中含有4个铜原子,铜晶胞的参数为a=x cm,铜晶胞的体积为x3cm3,密度$ρ=\frac{m}{V}$=$\frac{\frac{4×64}{{N}_{A}}}{{x}^{3}}$g/cm3=$\frac{256}{{N}_{A}{x}^{3}}$g/cm3,
故答案为:$\frac{256}{{N}_{A}{x}^{3}}$.
点评 本题涉及的知识点有晶胞的计算、等电子体、价层电子对互斥理论等知识点,利用均摊法、等电子体概念、价层电子对互斥理论来分析解答即可,题目难度中等;高考题中对于物质结构和性质的考查时,不是单纯的涉及一个考点,常常将各个考点融入到一个大型题中,考查知识较全面,要求学生对各个考点熟练掌握,一般来说,有关晶胞的计算较难.


科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、I- | |
| B. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| C. | 常温下,在c(H+)/c(OH-)=1×1012的溶液:NH4+、Mg2+、C1-、K+ | |
| D. | 水电离的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族族数 周期序数 | ||||||||
| ⑤ | ⑥ | ⑧ | ||||||
| ① | ③ | ④ | ⑦ | ⑩ | ||||
| ② | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g金属钠变成Na+,失去的电子数为0.2NA | |
| B. | 1.0L 1mol/L NaOH水溶液中含有的氧原子数为NA | |
| C. | 17g NH3所含的电子数为10NA | |
| D. | 9.5g MgCl2 溶于水所得溶液中含Cl-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
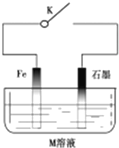
| A. | 常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀 | |
| B. | 关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑ | |
| D. | 关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Na+O2═2Na2O | B. | NH4HCO3═NH3↑+H2O+CO2↑ | ||
| C. | NH3+HCl═NH4C1 | D. | H2SO4+2NaOH═Na2SO4+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com