
分析 (1)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子;
(2)依据题干信息结合原子个数守恒确定产物,再根据氧化还原反应中得失电子数相等结合原子守恒配平写出方程式.
解答 解:(1)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,离子方程式为:Cl2+ClO2-=2ClO2+2Cl-;
故答案为:Cl2+ClO2-=2ClO2+2Cl-;
(2)由题意可知:KMnO4溶液与三氯乙烯反应,产物有MnO2,CO2,依据原子个数守恒可知其余产物为:KCl,HCl,该反应为氧化还原反应,KMnO4→MnO2,Mn元素由+7价→+4价,一个KMnO4分子得3个电子;C2HCl3→CO2,C元素由+1价→+4价,一个C2HCl3失去6个电子,依据得失电子守恒可知反应的方程式为:2KMnO4+C2HCl3═2KCl+2CO2↑+2MnO2+HCl;
故答案为:2KMnO4+C2HCl3═2KCl+2CO2↑+2MnO2+HCl.
点评 本题以含氯化合物为载体考查氧化还原反应知识,侧重于学生的分析能力的考查,注意抓住题干信息,依据氧化还原反应规律,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
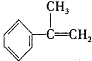 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式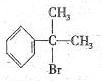 .
.
 ),其反应类型为:消去反应;
),其反应类型为:消去反应;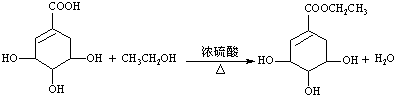 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
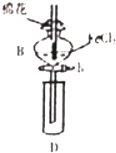 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程ⅠV中检出离子 | |
| 甲 | 有 Fe3+无 Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有S042- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
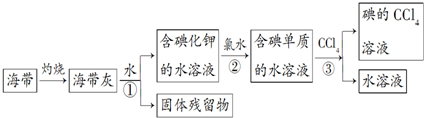
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃的镁条在二氧化碳中继续燃烧 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 酸碱中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去暖水瓶中的薄层水垢 | B. | 石油的分馏和煤的干馏 | ||
| C. | 用二氧化氯(ClO2)为自来水消毒 | D. | 液氨作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “血液透析”利用了胶体的性质 | |
| B. | 华裔科学家高琨因在光纤传输信息领域中取得突破性成就而获得诺贝尔奖,光纤的主要成分是高纯度的二氧化硅 | |
| C. | 玻璃钢是一种合金,广泛用于汽车车身 | |
| D. | 只要符合限量,“亚硝酸盐”、“食用色素”、“苯甲酸钠”可以作为某些食品的添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现象相同,沉淀质量相等 | B. | 现象相同,沉淀质量不相等 | ||
| C. | 现象不相同,沉淀质量相等 | D. | 现象不相同,沉淀质量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| D. | O2的摩尔体积约为22.4L.mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com