
| A. | 吸水性 | B. | 腐蚀性 | C. | 强氧化性 | D. | 易挥发性 |
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再改变 | |
| B. | 混合气体的平均分子量不再改变 | |
| C. | 混合气体中,N2、H2、NH3的物质的量之比为1:3:2 | |
| D. | 1个N≡N键断裂的同时,有6个N-H键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
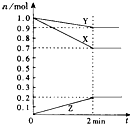 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:3X+Y
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:3X+Y 2Z
2Z查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
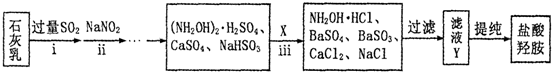
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
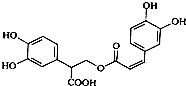
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和含6mol H2发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、消去反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com