
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z) | |
| B. | 气态氢化物的热稳定性:X>Y | |
| C. | 元素X的最高价氧化物对应的水化物是强酸 | |
| D. | 化合物XY、Z2Y、Z2Y2中化学键的类型相同 |
分析 短周期元素X、Y、Z的原子序数依次增大,Y原子的最外层电子数是次外层的3倍,则Y为O元素,XY2为红棕色气体,则为NO2,即X为N元素,Z的焰色反应呈黄色,则Z为Na元素,结合元素及其化合物的性质分析解答.
解答 解:短周期元素X、Y、Z的原子序数依次增大,Y原子的最外层电子数是次外层的3倍,则Y为O元素,XY2为红棕色气体,则为NO2,即X为N元素,Z的焰色反应呈黄色,则Z为Na元素,
A、原子半径:r(Na)>r(N)>r(O),即r(Z)>r(Y)>r(X),故A错误;
B、Y为O元素,X为N元素,非金属性O>N,则气态氢化物的稳定性:X<Y,故B错误;
C、X为N元素,元素X的最高价氧化物对应的水化物HNO3是强酸,故C正确;
D、NO中只含共价键,Na2O中只含有离子键,Na2O2中既含有离子键又含有共价键,所以化学键的类型不同,故D错误;
故选C.
点评 本题考查原子结构性质与位置关系、元素周期律、物质结构与化学键等,题目难度中等,推断元素是解题关键,注意基础知识的积累掌握.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 150 | 300 | 380 | 410 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分离水和酒精 | |
| B. |  蒸发NH4Cl溶液得到NH4Cl晶体 | |
| C. |  配制一定物质的量浓度溶液时转移溶液 | |
| D. |  除去氯气中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g O2含有的氧原子数目为2NA | |
| B. | 56 g的Fe在足量Cl2中完全燃烧转移电子数为2NA | |
| C. | 1 mol•L-1 Na2SO4溶液含有的钠离子数目为2NA | |
| D. | 标准状况下,22.4 L苯含有的碳原子数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
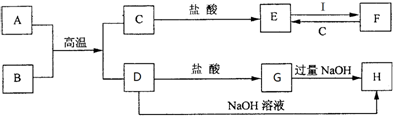

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1的Na2SO4溶液中含有的Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和S${O}_{4}^{2-}$的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol•L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸,产生白色沉淀,则试样中一定有Ag+ | |
| B. | 加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-或HCO3- | |
| C. | 加入NaOH溶液微热,产生使湿润红色石蕊试纸变蓝气体,则试样中一定有NH4+ | |
| D. | 加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则试样中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸 | |
| B. | Z元素在第三周期第ⅥA族 | |
| C. | W、Y、Z三种元素有两种是金属、一种是非金属 | |
| D. | W、X、Y三种元素的单质熔沸点依次降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com