
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中未成对电子最多的元素 |
| G的3d能级只含有2对成对电子 |
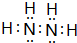 .
. 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.分析 A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.A元素的核外电子数和电子层数相等,则A为H元素;B元素原子的核外p电子数比s电子数少1,原子核外电子排布为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子价电子层的p轨道半满,价电子排布式为3s23p3,故D为P元素;E也处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中未成对电子最多的元素,F为第四周期元素,外围电子排布为3d54s1,故F为Cr;G的3d能级只含有2对成对电子,外围电子排布为3d74s2,故G为Co.
解答 解:A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.A元素的核外电子数和电子层数相等,则A为H元素;B元素原子的核外p电子数比s电子数少1,原子核外电子排布为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子价电子层的p轨道半满,价电子排布式为3s23p3,故D为P元素;E也处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中未成对电子最多的元素,F为第四周期元素,外围电子排布为3d54s1,故F为Cr;G的3d能级只含有2对成对电子,外围电子排布为3d74s2,故G为Co.
(1)N2H4分子中N原子形成3个键,含有去对孤对电子,N原子采取sp3杂化,为展开书页形结构,属于极性分子,N2H4的电子式: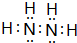 ,
,
故答案为:极性;sp3;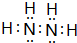 ;
;
(2)B为N元素,核外电子排布式为1s22s22p3,基态原子中能量最高的电子处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈哑铃形,
故答案为:3;哑铃;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为 ,该同学所画的电子排布图中3s能级中2个电子自旋方向相同,违背了泡利原理,
,该同学所画的电子排布图中3s能级中2个电子自旋方向相同,违背了泡利原理,
故答案为:泡利原理;
(4)PCl3分子中P原子形成3个键,含有1对孤对电子,价层电子对数为4,空间构型为三角锥形,
故答案为:三角锥形;
(5)G的3d能级只含有2对成对电子,核外电子排布为1s22s22p63s23p63d74s2,处于第四周期第Ⅷ族,属于d区元素,原子核外电子排布为,
故答案为:1s22s22p63s23p63d74s2;第Ⅷ;d;
(6)①xH2O+CoCl2=CoCl2•xH2O△m
131+18x 18x
119g (119-65)g
所以(131+18x):18x=119g:(119-65)g,
解得:x=6;
故答案为:6;
②该化合物CoCl2•6H2O中Co2+配位数为6,而且经定量测定得知配体和外界各占有Cl-个数为1:1,即各有1个氯离子,则内界中含有1个氯离子和5个水分子;外界有1个氯离子,另外还有1个结晶水,所以化学式可表示为:[CoCl(H2O)5]Cl•H2O,
故答案为:[CoCl(H2O)5]Cl•H2O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布规律、杂化方式与空间构型判断、元素周期表、配合物等,题目比较综合,难度中等,推断元素是解题的关键,注意基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②④不可以 | D. | 仅③可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•s-1,0.4 mol | B. | 0.2 mol•L-1•s-1,0.4 mol | ||
| C. | 0.2 mol•L-1•s-1,0.6 mol | D. | 0.4 mol•L-1•s-1,0.12 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
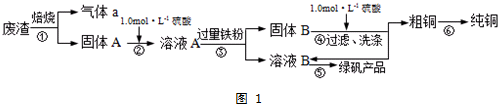
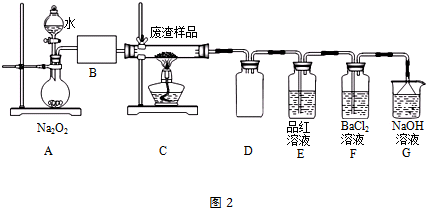
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
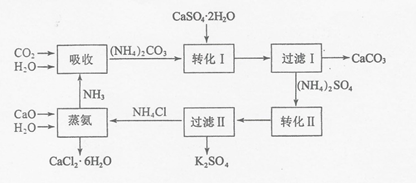
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com