
����Ŀ��ij��ȤС��ģ����ҵ�Ժ�����ˮ��Cr2O72����Cr3+������������ͼ1 
��֪��2CrO42��+2H+�TCr2O72��+H2O
��ش�
��1�������ӷ���ʽ��ʾ���ڳ�����ķ�Ӧ�� ��
��2��������õ��IJ����Ļ�ѧʽΪ ��
��3�����������pHʱ���ʺ���Ϊ���ڼ����� ��
A.4molL��1����
B.6molL��1����
C.ʯ����
D.̼����
��4��Ϊ�������ˮ�и��ĺ�����ȡ100mL���������Ʒ����ƿ�У���Ũ�������pH=5���������������忹��Ѫ�ᣬʹCr2O72����ȫת��ΪCr3+ �� ����amolL��1��EDTA����H4Y��ʾ������Һ���еζ����䷴Ӧԭ��Ϊ��Cr2O72����2Cr3+ �� Cr3++Y4��=CrY��
�ٵζ�ʱ������ͼ2��ʾ�IJ���Զ�����λ�ζ��ܣ����е��ŵ��� ��
��ʵ������EDTA����Һb mL���������Һ�к���Ũ��ΪmgL��1���ú�a��b��ʽ�ӱ�ʾ����
���𰸡�
��1��Cr2O72��+14H++6Fe2+=2Cr3++6Fe3++7H2O
��2��Fe��OH��3
��3��B
��4�������������������㾫ȷ��520ab
���������⣺������ˮ��Cr2O72����Cr3+���������������������������ڳط���������ԭ��Ӧ�ղ������Ӻ����ӣ���������������Һ���˵õ�����Ϊ����������������Һ��Cr��OH��4�� �� �����������������Һ������Cr��OH��4�� �� ����Na2CrO4 �� ������С������ҺPH��2CrO42��+2H+�TCr2O72��+H2O������ҺӦѡ�����ᣬ�����ױ��������Բ�ѡ�����ᣬ�õ���Na2Cr2O7��Һ����������KCl���˵õ�K2Cr2O7���壬��1�����ڳ�����ķ�Ӧ��������Һ���ظ�����������������������������ӵķ�Ӧ����Ӧ�����ӷ���ʽΪ��Cr2O72��+14H++6Fe2+=2Cr3++6Fe3++7H2O�����Դ��ǣ�Cr2O72��+14H++6Fe2+=2Cr3++6Fe3++7H2O����2��������֪��������õ��IJ���Ϊ������������ѧʽΪ��Fe��OH��3 �� ���Դ��ǣ�Fe��OH��3����3�����������pHʱ���ʺ���Ϊ���ڼ����Ƿǻ�ԭ�Ե��ᣬ
A��4molL��1����Ҳ�ᱻ�ظ������������������������A����
B��6molL��1������Һ���Ե�����ҺPH�����ữ���ã���B��ȷ��
C��ʯ����Ϊ����������Һ�����ܵ�����ҺPH�õ�Cr2O72�����ӣ���C����
D��̼������Һ�Լ��ԣ�2CrO42��+2H+�TCr2O72��+H2O��ƽ��������в��ܵõ�Cr2O72�����ӣ���D����
���Դ��ǣ�B����4�����Զ�����λ�ζ���ʹ�òⶨ�����ȷ���������ζ�ʱ������ͼ2��ʾ�IJ���Զ�����λ�ζ��ܣ����е��ŵ��ǣ������������������㾫ȷ��
���Դ��ǣ������������������㾫ȷ��
��Cr2O72����2Cr3+ �� Cr3++Y4��=CrY��
��Ӧ������ϵΪ��Cr2O72����2Cr3+��2H4Y��EDTA��
n��Cr3+��=n��EDTA��=amolL��1��b��10��3L=ab��10��3mol��
����õ������ӵ�Ũ��= ![]() =0.52abg/L=520ab mg/L��
=0.52abg/L=520ab mg/L��
���Դ��ǣ�520ab mg/L��


 Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д� ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ļ��Գɷ֣�����Ԥ�����ಡ��Ҳ�ܻ��⼡��ؽ���ʹ�����������������Ľṹ���Ա�ʾΪ��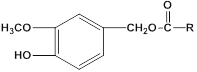 (RΪ����)������һ���������������J�ĺϳ�·�����£�
(RΪ����)������һ���������������J�ĺϳ�·�����£�
��֪��
��A��B��EΪͬϵ�����B����Է�������Ϊ44��A��B�˴Ź���������ʾ��������壻
�ڻ�����J�ķ���ʽΪC15H22O4��
��  +H2O
+H2O
�ش��������⣺
��1��G���������ŵ�����Ϊ��
��2����A��B����C�Ļ�ѧ����ʽΪ��
��3����C����D�ķ�Ӧ����Ϊ �� D�Ļ�ѧ����Ϊ��
��4����H����I�Ļ�ѧ����ʽΪ��
��5��J�Ľṹ��ʽΪ��
��6��G��ͬ���칹���У������ϵ�һ�ȴ���ֻ��һ�ֵĹ�����(���������칹)���˴Ź���������ʾ2������(д�ṹ��ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.CS2ΪV�εļ��Է���
B.ClO3�� �Ŀռ乹��Ϊƽ��������
C.SF6����6����ȫ��ͬ�ijɼ����Ӷ�
D.SiF4��SO32�� ������ԭ�Ӿ�Ϊsp3�ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.���ɵ��ʷ��ӵ���һ�����й��ۼ�
B.���Ȼ����У�ֻ���������Ӻ������ӵľ�����������
C.�������ڷǽ���Ԫ�غ���������Դ�����������ǿ
D.Ԫ����������Ԫ��ԭ�Ӻ�������Ų������Ա仯�Ľ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���ҹ���ɫ�������ϵ������н����������㷺��Ӧ���ڵ�������е���졢���������ش��������⣺
��ͭԭ�ӻ�̬�����Ų�ʽΪ�����þ����x�������䷨���Բ�ð���٤���������Խ���ͭ�IJⶨ�õ����½��������Ϊ�����������ܶѻ����߳�Ϊ361pm����֪ͭ���ܶ�Ϊ9.00gcm��3 �� ��٤������Ϊ����ʽ���㣬���������λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ���Ӽ������������Ӽ�ľ�������
B. ���н���Ԫ�������зǽ���Ԫ�ؼ䶼���γ����Ӽ�
C. ��ԭ������ԭ�ӽ�ϳ��Ȼ��ƺ���ϵ��������
D. �����ӻ�����CaCl2�У����������Ӽ�Ҳ�������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. �������Ӽ��Ļ�����һ�������ӻ�����
B. ������һ���ɽ���Ԫ�����
C. ���ӻ�������һ�����н���Ԫ��
D. �ǽ���Ԫ������ɵĻ������в����ܺ������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��������⣺
��1����ͼ��ʾ����һ��С�ձ��������ϸ��20g Ba��OH��28H2O���壮����С�ձ��������ȵ���3��4��ˮ�IJ���Ƭ�ϣ�Ȼ����С�ձ��м���10g NH4Cl���壬���ò��������ٽ��裮 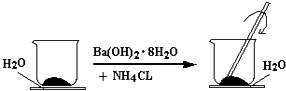
��ʵ���в�������������
��д���йط�Ӧ�Ļ�ѧ����ʽ����
���Ĵ������Ӧ���ͷ������÷�Ӧ��������
��ʵ���������˵���÷�Ӧ�ķ�Ӧ���������������ڡ���С�ڡ����������������
��2��������δ�����������Դ֮һ����ѧ��������Ƴ�����̫���ܲ������⣬���ڶ������ѣ�TiO2����������ʹ��ˮ�ֽ�õ��������¼�����2H2O ![]() 2H2��+O2�����Ƶõ�����������ȼ�ϵ�أ� �Իش��������⣺
2H2��+O2�����Ƶõ�����������ȼ�ϵ�أ� �Իش��������⣺
�ٺ�ˮ�ֽ����ɵ���������ȼ�ϵ��ʱ��ʵ����ת��Ϊ�ܣ�ˮ�ֽ�ʱ�����ѵĻ�ѧ��Ϊ�����ֽ⺣ˮ�ķ�Ӧ������Ӧ������ȡ������ȡ�����
��ij������ȼ�ϵ�����ù�������������մ�������ʣ������Ϸ����ĵ缫��Ӧ�ֱ�Ϊ��A����2H2+2O2����4e���T2H2O��B����O2+4e���T2O2�� �� ��A���ǵ�ص��������ӴӸü�������롱������������
�������Ի�ѧ��Ӧ��2Zn+O2+4H+�T2Zn2++2H2OΪ������Ƴ�һ��ԭ��أ�������������Ϊ������������Դ�����ǿ�������ѪҺ������һ��Ũ�ȵ�O2��H+��Zn2+���й�������ԭ��صĸ����Ϸ�����Ӧ�ĵ缫��ӦʽΪ ��
��3����������ȼ�չ����У��ƻ�1molH2�еĻ�ѧ�����ĵ�����ΪQ1kJ���ƻ�1molO2�еĻ�ѧ��ΪQ2kJ���γ�1molH2O�еĻ�ѧ���ͷŵ�����ΪQ3 �� ���й�ϵʽ��ȷ����
A.Q1+Q2��Q3
B.Q1+Q2��Q3
C.2Q1+Q2��2Q3
D.2Q1+Q2��2Q3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£������Ϊ2L�ĺ����ܱ������У�ijһ��Ӧ��X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ�����б�������ȷ���ǣ� �� 
A.��Ӧ�Ļ�ѧ����ʽΪ2X=3Y+Z
B.tʱ�������淴Ӧ�����ټ������У���Ӧ�ﵽ��ѧƽ��
C.��t=4����0��t��X�Ļ�ѧ��Ӧ����Ϊ0.1 molL��1min��1
D.�¶ȡ�������䣬tʱ�̳���1 mol Heʹѹǿ���������淴Ӧ���ʶ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com