
| 离子 | Fe2+ | Fe3+ | Cr3+ | Zn2+ |
| 开始沉淀的pH值 | 5.9 | 2.3 | 3.9 | 5.7 |
| 完全沉淀的pH值 | 8.3 | 3.2 | 5.6 | 8.3 |
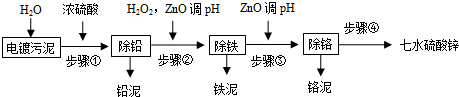
分析 镀污泥中包含大量难以降解的贵重金属离子,如Zn2+、Pb2+、Fe2+、Fe3+、Cr3+、Ca2+等,由流程可知,步骤①加水,再加浓硫酸,生成硫酸铅和硫酸钙,铅离子、钙离子沉淀下来,步骤②是过滤后向滤液中加入双氧水氧化亚铁离子,得到三价铁离子,再加氧化锌调节PH值为3.2到3.9,将三价铁离子全部沉淀,步骤③继续加入ZnO调pH到5.6,使铬离子全部沉淀,过滤得到的滤液中含有锌离子,通过蒸发浓缩、冷却结晶、洗涤、干燥得到产品,据此解答.
解答 解:(1)步骤①加水,再加浓硫酸,生成硫酸铅沉淀,离子方程式为:Pb2++SO42-=PbSO4↓,
故答案为:Pb2++SO42-=PbSO4↓;
(2)步骤②加入双氧水是为氧化亚铁离子,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,根据金属离子沉淀的PH值可知三价铁离子沉淀完全时,铬离子、锌离子不会沉淀,则加氧化锌调节PH值为3.2到3.9,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;3.2~3.9;
(3)铬离子水解离子方程式为:Cr3++3H2O?Cr(OH)3+3H+,步骤③加入ZnO消耗氢离子,ZnO+2H+=Zn2++H2O,平衡正向移动,铬离子沉淀完全,铬泥的主要成分是氢氧化铬,
故答案为:Cr3++3H2O?Cr(OH)3+3H+、ZnO+2H+=Zn2++H2O;Cr(OH)3;
(4)过滤得到的滤液为硫酸锌溶液,步骤④通过蒸发浓缩、冷却结晶、洗涤、干燥得到硫酸锌结晶水合物,
故答案为:蒸发浓缩、冷却结晶、洗涤;
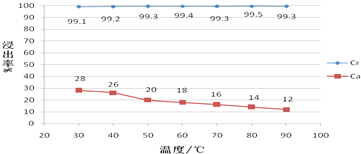
(5)Ca2+离子浸出率随温度的升高而减小,其原因是硫酸钙是微溶物且溶解度超过30℃以后,温度越高,溶解度越低;浓硫酸稀释过程中会放出大量的热,可让浸出液的温度维持在40-50℃,浸出渣的主要成分是硫酸铅、硫酸钙,
故答案为:硫酸钙是微溶物且溶解度超过30℃以后,温度越高,溶解度越低;浓硫酸稀释过程中会放出大量的热;硫酸铅、硫酸钙.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程分析及混合物分离方法、发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯乙烯分子的结构简式:H3C-CH2Cl | B. | 硫原子的结构示意图: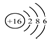 | ||
| C. | 过氧化钠的电子式: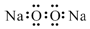 | D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
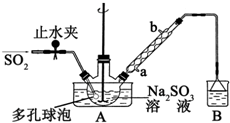 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
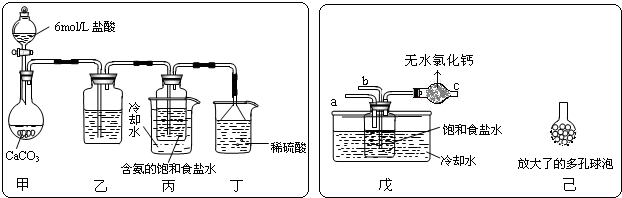
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.982 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
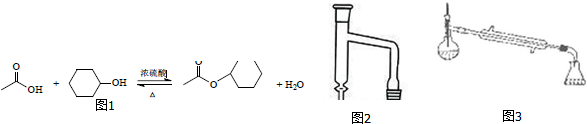
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com