
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A.原子半径由小到大的顺序:X<Y<Z<W
B.Y单质在一定条件下可以与氧化铁发生置换反应
C.室温下,0.1 mol· W的气态氢化物的水溶液的pH>1
W的气态氢化物的水溶液的pH>1
D.Z的最高价氧化物能与水反应生成相应的酸
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
下列说法正确的是( )
A.1 L CH3OH蒸汽与1 L水蒸气反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ
B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量
C.相同条件下1 mol CH3OH(g)与1 mol H2O(g)的能量总和小于1 mol CO2(g)与3 mol H2(g)的能量总和
D.1 mol CH3OH蒸汽与1 mol液态水反应生成1 mol CO2气体与3 mol氢气吸收的热量小于49.0 kJ
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:选择题
用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是( )
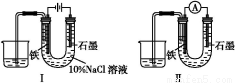
A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多
B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=Fe(OH)2↓
C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=H2↑
D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。汽车尾气中CO、NO2气体在一定条件下可以发生反应:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
(1)恒温恒容条件下,不能说明该反应已达到平衡状态的是 (填字母,下同)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v(NO2)逆=v(N2)正
D.容器内混合气体密度保持不变
(2)能使该反应的反应速率增大,且平衡向逆反应方向移动的是 。
A.及时分离出CO2
B.适当升高温度
C.减小容器体积使体系压强增大
D.选择高效催化剂
(3)对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 。
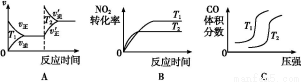
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定温度下,在固定容积的密闭容器中发生下列反应:2HI H2+I2。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
H2+I2。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
A.等于5 s B.等于10 s C.大于10 s D.小于10 s
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题5物质结构 元素周期律练习卷(解析版) 题型:选择题
元素的原子结构决定其性质和在周期表中的位置,下列有关结构和性质的说法中,正确的是( )
A.形成离子键的阴阳离子间只存在静电吸引力
B.元素周期表中,第三周期最右端的元素原子得电子能力最强
C.最易失去的电子能量最高
D.目前使用的元素周期表中最长的周期含有36种元素
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:选择题
盖斯定律认为能量总是守恒的,不管化学反应过程是一步完成或分几步完成,整个过程的热效应是相同的。
已知:①H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol
②C2H5OH(g)=C2H5OH(l) ΔH2=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH3=-Q3 kJ/mol
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)( )
A.Q1+Q2+Q3 B.1.5Q1-0.5Q2+0.5Q3
C.0.5Q1-1.5Q2+0.5Q3 D.0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题2化学常用计量 溶液练习卷(解析版) 题型:填空题
某固体混合物含NH4I、NaHCO3、AlCl3、MgBr2、FeCl2中的几种,为确定该固体混合物的成分及各组成成分的物质的量之比,现进行如下实验。
实验Ⅰ:

(1)无色气体为 。
(2)该固体混合物的成分为 。
实验Ⅱ:取一定量的该固体混合物溶于水配成1 L溶液,并向该混合溶液中通入一定量的Cl2,测得溶液中几种阴离子(分别用A-、B-、C-表示)的物质的量与通入Cl2体积的关系如表所示。
Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
n(A-)/mol | 1.25 | 1.5 | 2 |
n(B-)/mol | 1.5 | 1.4 | 0.9 |
n(C-)/mol | a | 0 | 0 |
(3)a= 。
(4)原固体混合物中各组成成分的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题12化学实验基本操作与方案设计练习卷(解析版) 题型:实验题
Ⅰ.铁是人体必需的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是 ;实验室在配制FeSO4溶液时常加入 以防止其被氧化。请你设计一个实验证明FeSO4溶液是否被氧化 。
Ⅱ.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(2)硫酸亚铁铵不易被氧化的原因是 。
(3)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
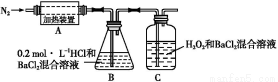
①A中固体充分加热较长时间后,通入氮气,目的是 。
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的现象为 。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com