
| A. | 碱性氧化物均为金属氧化物 | |
| B. | 一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 | |
| C. | 酸根离子中不可能含有金属元素 | |
| D. | 还原产物只有还原性,氧化产物只有氧化性 |
分析 A.能跟酸起反应,生成盐和水的氧化物叫碱性氧化物;
B.同种化合价可以对应几种氧化物;
C.根据高锰酸跟离子、偏铝酸根离子的元素组成情况来回答判断;
D.根据元素的化合价判断是否有氧化性和还原性;
解答 解:A.能跟酸起反应,生成盐和水的氧化物叫碱性氧化物,碱性氧化物均为金属氧化物,故A正确;
B.一种元素可能有多种氧化物,同种化合价可以对应不同氧化物,如氮元素+4价对应NO2、N2O4,钠元素的氧化物有氧化钠和过氧化钠两种,其中钠元素的化合价只有+1价,故B错误;
C.高锰酸跟离子、偏铝酸根离子属于酸根离子,其中含有金属元素,酸根离子中可以含有金属元素,故C错误;
D.根据元素的化合价判断是否有氧化性和还原性,最低价只有还原性,最高价只有氧化性,则还原产物也可能有氧化性,氧化产物也可能有还原性,故D错误.
故选A.
点评 本题考查了氧化物的性质、氧化物的组成、酸根离子的构成、氧化还原反应中概念的理解应用等,题目难度不大,注意对基础知识的积累.


科目:高中化学 来源: 题型:解答题
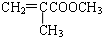 )是生产有机玻璃的单体.
)是生产有机玻璃的单体. .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$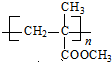 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇沸点是78.5℃,将含水酒精直接加热蒸馏可制得无水酒精 | |
| B. | 除去二氧化碳气体中混有的少量氯化氢气体,可以将气体通过饱和碳酸氢钠溶液 | |
| C. | 可以用醋酸除去锅炉中的水垢(主要成分为碳酸钙) | |
| D. | 仅采用物理方法无法将晾晒海水得到的粗盐转变为精盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
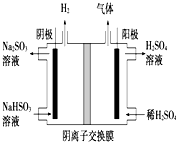 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:| 温 度 | 200℃300℃400℃ |
| 平衡常数 | K1 K2 K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
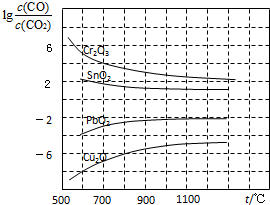 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
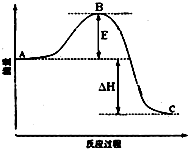 安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.
安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/L Na2CO3溶液中,CO32-的数目小于0.1NA个 | |
| B. | 标准状况下,6.0 g乙酸含有0.3 NA个C-H键 | |
| C. | 32gCu与足量硫黄充分反应,转移NA个电子 | |
| D. | 31g白磷(P4)中含有6 NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2在任何情况下都是32g | B. | 摩尔是一个基本物理量 | ||
| C. | H2SO4的摩尔质量是98g | D. | 1摩尔氢的质量是2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com