
����Ŀ������������������ʵ����������������������泥���������Ļ�ѧʽΪ( NH4)2Fe(SO4)2��6H2O�������ʿ�������ˮ���������Ҵ�����һ�ָ��Σ��ڿ����б�һ���������ȶ�����������������ԭ�ζ��Ļ��������ijʵ��С����ȡ��������淋IJ���װ����ʵ�鲽�裺
�ٳ�ȡԼ5 g��м������ƿ�У�����15 mL 10% Na2CO3��Һ��С�����10���ӣ�����ʣ��ļ�Һ��������ˮϴ����м�����
�ڳ�ȡ2.24 g ��м������ƿ�У��ɷ�Һ©���μ�20 mL 3 mol/L������Һ��
�۴���Ӧ�������ɷ�Һ©������������(NH4)2SO4��Һ���������������Һת�����������У��������ȣ�Ũ����������־�ĤΪֹ��
�ܷ�����ȴ���������壬���ˡ�����ˮ�Ҵ�ϴ�ӡ����
��ش��������⣺
��1������A��������___________��
��2��ʵ�鿪ʼǰ����鷴Ӧװ�������Եķ���Ϊ_______________________________��
��3���������С����ȵ�������________________________��
��4��������еμ�������Һʱ��ȡ������Һ�ڷ�Һ©���е�ԭ����___________________��
��5��������������������2 mol/L (NH4)2SO4��Һ______________mL��
��6����ˮ�Ҵ�ϴ�Ӿ����������_______________________________��
��7��ȡ1.00 g���������Ʒ���ټ��������ữ�������250 mL��Һ��ȡ��25.00 mL����Ũ��Ϊ0.1000 mol/L��(NH4)2Fe(SO4)2����Һ�ζ����յ�ʱ��ȥ��Һ20.00 mL����ζ�ʱ������Ӧ�����ӷ���ʽΪ_____������Ʒ�и�����ص���������Ϊ_____________��
���𰸡���Һ©�� �رշ�Һ©����������ֹˮ�У������ܿ�����ˮ����Һ�����£�����ƿ�������ܿ������ݲ�����ֹͣ����һ��ʱ������ڵ����γ�һ��ˮ������Ӧװ������������ �ٽ�Na2CO3ˮ�⣬��ǿȥ�������� ��Һ�����ã���ֹFe2+�������� 20 ��ȥ��������ˮ�� MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O 63.2%
��������
(1)����װ��ͼ����ϳ��������Ľṹ�������
(2)��鷴Ӧװ�õ������ԣ���Ҫ�γ�һ������ܷ�Ŀռ䣬��������������������۲������жϣ��ݴ˷������
(3)̼�����ܹ�ˮ�⣬�����¶ȣ�ˮ��̶�����ȥ��������ǿ���ݴ˽��
(4)������Һ�ڷ�Һ©�������Է�ֹ��������װ�ã���Fe2+������
(5)��������������������ʵ����������������������泥�����������ݼ��㣻
(6)��ˮ�Ҵ�������ˮ�����Ҵ����ӷ���
(7)��������ܹ�����������������Fe3+����������ԭΪMn2+���������ĵı�Һ���������ӵ����ʵ���������Ʒ�и�����ص�����������
(1)����װ��ͼ������AΪ��Һ©�����ʴ�Ϊ����Һ©����
(2)ʵ�鿪ʼǰ����Ҫ���÷�Ӧװ�������ԣ��������Ϊ���رշ�Һ©����������ֹˮ�У������ܿ�����ˮ����Һ�����£�����ƿ�������ܿ������ݲ�����ֹͣ����һ��ʱ������ڵ����γ�һ��ˮ������Ӧװ�����������ã��ʴ�Ϊ���رշ�Һ©����������ֹˮ�У������ܿ�����ˮ����Һ�����£�����ƿ�������ܿ������ݲ�����ֹͣ����һ��ʱ������ڵ����γ�һ��ˮ������Ӧװ�����������ã�
(3)������г�ȡԼ5 g��м������ƿ�У�����15 mL 10% Na2CO3��Һ��С�����10���ӣ�С����ȴٽ�̼����ˮ�⣬��Һ�ļ�����ǿ��ȥ��������ǿ���ʴ�Ϊ���ٽ�Na2CO3ˮ�⣬��ǿȥ����������
(4)������еμ�������Һʱ��ȡ������Һ�ڷ�Һ©����������Һ�����ã���ֹ��������װ�ã���Fe2+�������ʴ�Ϊ����Һ������(��ֹFe2+������)��
(5)2.24 g �������ʵ���=![]() =0.04mol�������ᷴӦ���Եõ�0.04mol FeSO4������������������ʵ����������������������泥������Ҫ�����0.04mol�������2 mol/L (NH4)2SO4��Һ�����Ϊ
=0.04mol�������ᷴӦ���Եõ�0.04mol FeSO4������������������ʵ����������������������泥������Ҫ�����0.04mol�������2 mol/L (NH4)2SO4��Һ�����Ϊ![]() =0.02L=20mL���ʴ�Ϊ��20��
=0.02L=20mL���ʴ�Ϊ��20��
(6)��ˮ�Ҵ��ܹ���ˮ����������ܣ����Ҵ����ӷ�������ˮ�Ҵ�ϴ�Ӿ��壬���Գ�ȥ��������ˮ�֣��ʴ�Ϊ����ȥ��������ˮ�֣�
(7)��������ܹ������������ӣ���Ӧ�����ӷ���ʽΪMnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O�����ĵı�Һ���������ӵ����ʵ���=0.1000 mol/L��0.0200L=0.002mol�����ݷ���ʽ��������ص����ʵ���=![]() ��0.002mol=0.0004mol������Ʒ�и�����ص���������=
��0.002mol=0.0004mol������Ʒ�и�����ص���������=![]() ��100%=63.2%���ʴ�Ϊ��MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O��63.2%��
��100%=63.2%���ʴ�Ϊ��MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O��63.2%��


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10mL0.1mol/L��HR��Һ����μ���0.1mol/L�İ�ˮ��������ҺpH�������Ա仯��ͼ�����з�����ȷ����

A. a~c�㣬��Һ��������Ŀ��������С
B. b����ҺpH=7˵��c(NH4+)=c(R��)
C. c����Һ����c(NH4+)>c(R��)>c(H+)>c(OH��)
D. b��c�����Ӧ��Һ�У�ˮ�ĵ���̶���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3�Ĵ������ǹ�ҵ��ȡ����Ĺؼ�����֮һ���÷�Ӧ�Ļ�ѧ����ʽΪ��4NH3(g)+5O2(g) ![]() 4NO(g)��6H2O(g)����H��0��
4NO(g)��6H2O(g)����H��0��
��ش��������⣺
��1���ں��º������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��______������ĸ����
a��NH3��NOŨ����� b��NO�ٷֺ������ֲ���
c�������������ѹǿ���� d��NH3������������NO�������������
��2�����÷�Ӧ����ƽ��״̬ʱ�����������������£����д�ʩ�����������NH3ƽ��ת���ʵ���_____________��������ĸ��
a����װ�����ٳ���N2 b����װ�����ٳ���O2
c���ı䷴Ӧ�Ĵ��� d�������¶�
��3����0.050 mol NH3 (g)��0.060 mol O2(g)�����ݻ�Ϊ1L���ܱ������У���һ�������´ﵽƽ�⣬���c(NO)��0.040 mol/L������������·�Ӧ��NH3��ת������ƽ��ʱ��NH3��ת������(NH3 )=_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
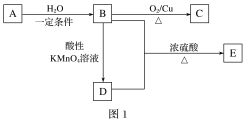
����Ŀ��A��B��C��D��EΪ���ֳ������л������֮���ת����ϵ��ͼ1��ʾ������A��һ�ֿ���ʹ��ˮ������KMnO4��Һ��ɫ�����壬����Ϊˮ���Ĵ������D���ӵ�ģ����ͼ2��ʾ��

��ش��������⣺
(1)��B����C�ķ�Ӧ������________��
(2)A�Ľṹ��ʽΪ________��D�еĹ�����Ϊ______��
(3)B��D��Ӧ����E�Ļ�ѧ����ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯��������������������Ҫ���á�
��1����֪����������ȼ����Ϊ285 kJ/mol ��N2(g) + 2O2(g) = 2NO2(g) ��H=+133 kJ/mol����д��H2��ԭNO2����Һ̬ˮ����һ�������ʵ��Ȼ�ѧ����ʽ_________________��
��2��һ�Ȱ�(NH2Cl)�ĵ���ʽΪ_______________��һ�Ȱ�����Ҫ��ˮ����������ԭ����һ�Ȱ���ˮ�лᲿ��ˮ�⣬���ɾ���ǿ��ɱ�����õ����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��3����Cl2��NH3��Ӧ�Ʊ����Ȱ��ķ���ʽΪ2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g)�����ݻ���Ϊ1 L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T��)�����зֱ����2 mol Cl2��2 mol NH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
NHCl2(l)+2HCl(g)�����ݻ���Ϊ1 L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T��)�����зֱ����2 mol Cl2��2 mol NH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 20 | 40 | 60 | 80 |
n(Cl2)(������)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (������)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�ٸ÷�Ӧ�Ħ�H______0(�>����<��) ���������У�0��40 min����Cl2��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(Cl2)=_______________________��
�ڶԸ÷�Ӧ������˵������ȷ����________________(��ѡ����ĸ����
A�����������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬
B������������Cl2��NH3���ʵ���֮�Ȳ��䣬�������Ӧ�ﵽƽ��״̬
C����Ӧ�ﵽƽ��������������NHCl2�����������Cl2��ת����
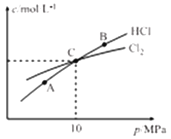
�ۺ��������£����ƽ��ʱCl2��HCl�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ����A��B��C������Cl2ת������ߵ���_________(�A����B����C��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ӦC(s)��H2O(g)![]() CO(g)��H2(g)���ܱ������н��У�һ��ʱ���ﵽƽ�⣬���д�ʩ����ʹƽ�ⷢ���ƶ�����( )
CO(g)��H2(g)���ܱ������н��У�һ��ʱ���ﵽƽ�⣬���д�ʩ����ʹƽ�ⷢ���ƶ�����( )
������C�����ʵ�����������������䣬����N2ʹ��ϵѹǿ�������������������Сһ�롡������ѹǿ���䣬����N2ʹ����������
A. �٢� B. �ڢ� C. �٢� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
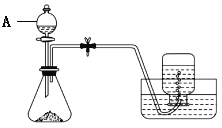
����Ŀ����ͼ��ʾ��������A�е�Ũ����μӵ�ʢ��MnO2����ƿ�У����Ⱥ��������������ͨ��װ��B��C��Ȼ����ͨ�����ȵ�ʯӢ������D�����������ۣ�����ش�

��1������A��������__����ƿ�з�Ӧ�Ļ�ѧ����ʽ��__��
��2��װ��B��ʢ��Һ����__������ͨ��װ��B��Ŀ����__��װ��C��ʢ�ŵ�Һ����__��
��3��D�з�Ӧ�Ļ�ѧ����ʽ��__��
��4���ձ�E��ʢ�ŵ�Һ����__����Ӧ�����ӷ���ʽ��__��
��5�����ϱ���D�в������������ʣ�����������������ȴ��������������H2O��g�����ҷ�Ӧ��Ϊ�ռ�D�в����D��E֮�䣬�������ռ�װ���⣬����Ҫ����__װ�á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2(g)+O2(g)![]() 2SO3(g) ��H=-197kJ��mol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��)2molSO2��lmolO2��(��) lmolSO2��0.5molO2��(��)2 mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
2SO3(g) ��H=-197kJ��mol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��)2molSO2��lmolO2��(��) lmolSO2��0.5molO2��(��)2 mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
A. ������ѹǿP��P��=P��>2P��
B. SO3������m��m��=m��>2m��
C. c(SO2)��c(O2)֮�� k��k��=k��>k��
D. ��Ӧ�ų���������������ֵQ��Q��=Q��>2Q��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com