
金属晶体、离子晶体和分子晶体采取密堆积方式的原因是( )
A.构成晶体的微粒均可视为圆球
B.金属键、离子键、分子间作用力均无饱和性和方向性
C.三种晶体的构成微粒相同
D.三种晶体的构成微粒多少及相互作用力相同
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.氯化钠晶体结构为非等径圆球的密堆积
B.晶体尽量采取紧密堆积方式使其变得比较稳定
C.由于共价键有方向性和饱和性,所以原子晶体不遵循紧密堆积原则
D.金属铜和镁均以…ABAB…方式堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
在形成氨气分子时,氮原子中的原子轨道发生sp3杂化生成4个________________,生成的4个杂化轨道中,只有________个含有未成对电子,所以只能与____________个氢原子形成共价键,又因为4个sp3杂化轨道有______________,所以氨气分子中的键角与甲烷不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
从我们熟悉的食盐、金属、冰到贵重的钻石等都是晶体,而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A.是否具有规则几何外形的固体
B.是否具有固定组成的物质
C.是否具有美观对称的外形
D.内部基本构成微粒是否按一定规律做周期性重复排列
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列九种晶体:A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.过氧化钾 H.金刚石 I.镁
(1)属于原子晶体的化合物是________,直接由原子构成的晶体是________,直接由原子
构成的分子晶体是________。
(2)由极性分子构成的晶体是________,含有共价键的离子晶体是________,属于分子晶
体的单质是________。
(3)受热熔化后化学键不发生变化的是__________,需克服共价键的是________,需要克服金属键的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于离子键的说法中正确的是( )
A.离子键一定在活泼金属和活泼非金属元素的原子之间形成
B.形成离子键时离子间的静电作用指的是静电吸引
C.形成离子键时,离子半径越大离子键就越强
D.非金属元素的原子之间也可以形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机化合物的认识正确的是( )
A.苯、乙醇、乙酸和酯类都可以发生取代反应
B.乙酸和乙酸乙酯互为同分异构体
C.汽油、煤油、植物油都可以燃烧,它们的主要成分也相同
D.糖类、油脂与蛋白质是基本营养物质,它们都是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温下,9 g H2O中含NA个O—H键
B.1 mol Fe2+与足量稀硝酸反应,转移3NA个电子
C.常温常压下,22.4 L SO2和O2的混合气体中含2NA个氧原子
D.0.1 mol·L-1KAl(SO4)2溶液中含0.2NA个SO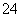
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com