
 .
.分析 A、B、C、D、E五种短周期元素的原子序数依次增大.B原子的质子数是其电子层数的4倍,则B为O或Mg,由于A原子的最外层电子比B原子的最外层电子少2个,故B为O元素,A为C元素;A、B、C三种元素能结合成化合物C2AB3,在1molC2AB3中共有52mol电子,则C原子电子数为$\frac{52-6-8×3}{2}$=11,故C为Na;D元素的单质0.5mol与酸全部反应时,有9.03×1023个电子转移,转移电子为1.5mol,则D元素化合价为+3,故D为Al;E元素的单质是一种黄绿色气体,水溶液具有漂白性,则E为Cl,据此解答.
(1)主族元素周期数=电子层数,主族族序数=最外层电子数;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
(3)由元素B、C形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为Na2O2,由钠离子与过氧根离子构成;
(4)分别有碳和Al做为电极,用导线连接后浸入HCl的水溶液中,可以构成原电池,本质是Al与盐酸反应生成氯化铝与氢气,负极发生氧化反应,正极发生还原反应;
(5)锗位于硅的下一周期,应处于第四周期第ⅣA族;处于金属和非金属分界线附近,表现一定的金属性、非金属性,可以用作半导体材料;
非金属性越强,与氢气反应越容易;
(6)Al与Ga处于同主族,最外层电子数相同,具有相似的化学性质;
利用Ga(OH)3是否溶于强酸、强碱判断其是否是两性氢氧化物.
解答 解:A、B、C、D、E五种短周期元素的原子序数依次增大.B原子的质子数是其电子层数的4倍,则B为O或Mg,由于A原子的最外层电子比B原子的最外层电子少2个,故B为O元素,A为C元素;A、B、C三种元素能结合成化合物C2AB3,在1molC2AB3中共有52mol电子,则C原子电子数为$\frac{52-6-8×3}{2}$=11,故C为Na;D元素的单质0.5mol与酸全部反应时,有9.03×1023个电子转移,转移电子为1.5mol,则D元素化合价为+3,故D为Al;E元素的单质是一种黄绿色气体,水溶液具有漂白性,则E为Cl.
(1)元素B为O元素,处于周期表中第二周期ⅥA族,故答案为:第二周期ⅥA族;
(2)元素C、D、E形成的简单离子分别为Na+、Al3+、Cl-,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:Cl->Na+>Al3+,故答案为:Cl->Na+>Al3+;
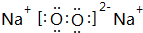
(3)由元素B、C形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为Na2O2,其电子式为 ,故答案为:
,故答案为: ;
;
(4)分别有碳和Al做为电极,用导线连接后浸入HCl的水溶液中,可以构成原电池,Al与盐酸反应生成氯化铝与氢气,故Al为负极,碳为正极,故答案为:正极;
(5)锗位于硅的下一周期,根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种可能的用途是:作半导体材料;锗的非金属性比硅弱,硅和锗单质分别与H2反应时,反应较难进行的是锗,
故答案为:半导体材料;锗;
(6)镓与铝同主族,且位于铝的下一周期,它们原子最外层均为3个电子,镓与铝性质相似,
GaCl3溶液与NaOH溶液反应生成Ga(OH)3,再利用Ga(OH)3是否溶于强酸、强碱判断其是否是两性氢氧化物,故需要的试剂还有:NaOH溶液、稀硫酸或盐酸,
故答案为:镓、铝原子最外层均为3个电子;NaOH溶液;稀硫酸或盐酸.
点评 本题考查结构性质位置关系应用,侧重同主族元素化合物性质相似性与递变性考查,难度不大,注意基础知识的理解掌握.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油裂解可获得乙烯,可从煤干馏得到的煤焦油中提取苯 | |
| B. | 衣服中的棉、麻成分都属于纤维素 | |
| C. | 用纯碱制玻璃,用铁矿石炼铁都会产生温室气体CO2 | |
| D. | 地沟油和矿物油的主要化学成分相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中,电子层数越多,半径一定越大 | |
| B. | 元素周期表中,同一主族,随着核电荷数的递增,熔沸点逐渐降低 | |
| C. | 非金属元素与非金属元素之间可能形成离子键 | |
| D. | 含有离子键的物质一定是离子化合物,只含共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应物键能之和大于生成物键能之和,则该反应为放热反应 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 因为水分子内存在氢键,所以水的沸点比硫化氢的沸点高 | |
| D. | 需要加热才能发生的化学反应不一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 1mol•L-1 | C. | 0.5mol•L-1 | D. | 0.25mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mo/L | B. | 1.5mo/L | C. | 2mo/L | D. | 4mo/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| P代表的是压强 | c%是氨气百分含量 | 1molN2和3molH2反应达平衡放出热量92kJ | 平衡常数:Kb>Ka |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com