
分析 阴极上阳离子放电顺序为Ag+>Cu2+>H+>Na+,阳极上阴离子放电顺序为Cl->OH->SO42-、NO3-,
(1)当阴极放出H2,阳极放出O2时,则溶液中的电解质不放电,根据离子的放电顺序分析;
(2)当阴极析出金属,则金属离子为Cu2+或Ag+,阳极放出O2时,阴离子为SO42-或NO3-;
(3)当阴极放出H2,则阴极为H+放电,阳极放出Cl2阴离子为Cl-放电,此时两极分别放出气体,且体积比为1:1.
解答 解:阴极上阳离子放电顺序为Ag+>Cu2+>H+>Na+,阳极上阴离子放电顺序为Cl->OH->SO42-、NO3-,
(1)当阴极放出H2,阳极放出O2时,则溶液中的电解质不放电,溶液中阳离子为H+,阴离子为SO42-或NO3-,所以电解质是HNO3、H2SO4、Ba(NO3)2中的任意一种,但不能是BaSO4.
故答案为:HNO3、H2SO4、Ba(NO3)2;
(2)当阴极析出金属,则金属离子为Cu2+或Ag+,阳极放出O2时,阴离子为SO42-或NO3-;所以电解质是CuSO4或AgNO3或Cu(NO3)2中的任意一种,
故答案为:CuSO4、AgNO3、Cu(NO3)2;
(3)当阴极放出H2,则阴极为H+放电溶液中的阳离子为H+,阳极放出Cl2阴离子为Cl-放电,所以电解质为HCl、BaCl2中的任意一种,
故答案为:HCl或BaCl2.
点评 本题考查电解原理,明确离子的放电顺序是解答本题的关键,注意电极材料与发生的电极反应即可解答,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸稀释后立即转移到容量瓶中 | |
| B. | 将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| C. | 将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 | |
| D. | 用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
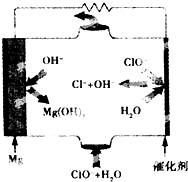 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 池总反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| B. | 正极反应式为ClO-+H2O+2e-=Cl-+2OH- | |
| C. | 该燃料电池中镁为负极,发生还原反应电 | |
| D. | 放电过程中OH-移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖无毒,为了探究它的甜味,可从试剂瓶中取少量进行品尝 | |
| B. | 氯化氢气体极易溶于水,吸收氯化氢尾气时应考虑添加防倒吸装置 | |
| C. | 欲配制少量稀硫酸溶液,可取少量浓硫酸于试管中加水稀释 | |
| D. | 酒精灯不用时可用扇子扇灭,既简便又快捷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ③>①>④>② | C. | ①>③>④>② | D. | ②>③>④>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com