
(2001·理综)关于氢键,下列说法正确的是
[ ]
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.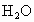 是一种非常稳定的化合物,这是由于氢键所致
是一种非常稳定的化合物,这是由于氢键所致
|
思路分析:含有活泼的非金属和氢形成的化学键 (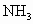 、 、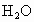 、HF、醇、羧酸、氨基酸等)的物质,它们的分子间存在一种比一般分子间作用力大的作用,叫“氢键”,从本质上讲,它不属于化学键.在化学上,含有氢键的物质,其熔点、沸点、密度等物理性质有点“反常”. 、HF、醇、羧酸、氨基酸等)的物质,它们的分子间存在一种比一般分子间作用力大的作用,叫“氢键”,从本质上讲,它不属于化学键.在化学上,含有氢键的物质,其熔点、沸点、密度等物理性质有点“反常”.
A .水分子内不存在氢键;B.冰和水中存在氢键,而水蒸气不存在氢键;C.DNA中有四种碱基:A、G、C、T,它们之间A和T、C和G通过氢键配对,并且配对方式惟一,这就是碱基互补配对原则;D.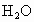 是一种非常稳定的化合物,这是由于分子内化学键键能大所致,与氢键无关. 是一种非常稳定的化合物,这是由于分子内化学键键能大所致,与氢键无关. |
|
温馨提示:该题是一道生化学科间综合题,考查学生对氢键的存在和作用的了解. |


科目:高中化学 来源: 题型:

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解




查看答案和解析>>
科目:高中化学 来源: 题型:013
(2001·理综)已知天然气的主要成分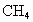 是一种会产生温室效应的气体.等物质的量的
是一种会产生温室效应的气体.等物质的量的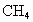 和
和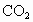 产生的温室效应前者大.下面是有关天然气的几种叙述:①天然气与煤、柴油相比是比较清洁的能源;②等质量的
产生的温室效应前者大.下面是有关天然气的几种叙述:①天然气与煤、柴油相比是比较清洁的能源;②等质量的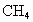 和
和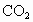 产生的温室效应也是前者大;③燃烧天然气,也是酸雨的成因之一.其中正确的是
产生的温室效应也是前者大;③燃烧天然气,也是酸雨的成因之一.其中正确的是
[ ]
查看答案和解析>>
科目:高中化学 来源: 题型:
锶(Sr)位于元素周期表的第5周期IIA族。碳酸锶(SrCO3)是一种重要的无机产品:被广泛用于彩色电视机的阴极射线管。以天青石和碳酸钠溶液混合浸泡制取碳酸锶的离子方程式是:SrSO4十CO32- SrCO3 +SO42-,△H
请回答下列问题:
(1)下列关于锶及其化合物的叙述中,错误的是___________。
A.锶比钙的金属性强,单质能和水反应放出氢气
B.氢氢化锶呈两性
C.SrCO3难溶于水
D.锶在化合物中呈十2价
(2)当温度升高,上述反应速率增大,但硫酸锶的转化率降低,则说明上述反应的△H__________0 (填“>”、“<”或“==:”)
(3)写出上述反应平衡常数的表达式:K=___________;
若已知Ksp(SrSO4)=3×10-7,Ksp(SrCO3)= 1×10-10,
则该反应的平衡常数的数值是____________;
泉州市质检理综 第10页(共14页)
(4)如果将Na2CO3换成(NH4)2CO3,SrCO3的产率将降低,这与Na2CO3溶液和
(NH4)2CO3溶液的pH有关,当两者浓度、温度均相同时,Na2CO3溶液的pH
____________(填“>”、“<”或“=”)(NH4)2CO3溶液的pH;
(5)另一种以天青石为原料制备碳酸锶的方法是:将天青石粉碎后在1000℃
~1200℃时与碳反应制得可溶性的硫化锶,再由硫化锶经一系列反应制碳酸锶。其中发生的化学反应有:4C(s)+SrSO4(s)=SrS(s) +4CO(g),△H1;SrS(s)+2O2(g)=SrSO4(s),△H2;2C(s)+O2(g) == 2CO(g),△H3;已知:
△H2 = akJ?mol-1。;△H 3 = b kJ?mol-1
则△H1__________(用含a和b的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com