
分析 (1)工业上用氯气和氢气制取氯化氢,制取硝酸时先用氢气和氮气制取氨气,然后再用氨气制取NO、二氧化氮和硝酸;
(2)工业上生产硫酸与硝酸时,用到的相同的重要设备是触媒室(催化装置)和吸收塔,制硫酸用到接触室二氧化硫氧化为三氧化硫,吸收塔是吸收三氧化硫,制硝酸时氨气的催化氧化需在氧化炉中催化氧化,吸收塔是吸收二氧化氮;
(3)浓硝酸不稳定,易分解生成二氧化氮、氧气和水;
(4)浓硫酸与浓硝酸都可用铁、铝容器贮存的相同原理是强氧化性(使金属钝化),常温下浓硫酸、浓硝酸遇到铁和铝发生钝化现象,在金属表面形成致密的氧化物薄膜阻止了反应继续进行,所以可以再常温下浓硫酸与浓硝酸都可用铁、铝容器贮存;
(5)浓盐酸与浓硝酸暴露在空气中,相同的现象是白雾,因为氯化氢和硝酸都是易挥发的物质,遇到空气中水蒸气会溶于水形成盐酸小液滴和硝酸小液滴,所以形成白雾.
解答 解:(1)工业上生产盐酸与硝酸时,都要用到的气态反应物是H2,制备硝酸时要制备氨气,需要氢气,氯化氢是由氯气和氢气化合得到,故答案为:氢气;
(2)制硫酸用到接触室二氧化硫氧化为三氧化硫,吸收三氧化硫在吸收塔,制硝酸时氨气的催化氧化需在氧化炉中催化氧化,得到的二氧化氮在吸收塔中吸收,
故答案为:吸收塔,催化氧化在接触室或氧化炉中;
(3)浓硝酸不稳定,易分解生成二氧化氮、氧气和水,生成的二氧化氮溶于硝酸而导致溶液呈黄色,反应方程式为4HNO4$\frac{\underline{\;光或加热\;}}{\;}$4NO2↑+O2↑+2H2O,故答案为:4HNO4$\frac{\underline{\;光或加热\;}}{\;}$4NO2↑+O2↑+2H2O;
(4)常温下浓硫酸、浓硝酸遇到铁和铝发生钝化现象,在金属表面形成致密的氧化物薄膜阻止了反应继续进行,所以可以再常温下浓硫酸与浓硝酸都可用铁、铝容器贮存,
故答案为:铁、铝被浓H2SO4或浓HNO3钝化;
(5)因为氯化氢和硝酸都是易挥发的物质,遇到空气中水蒸气会溶于水形成盐酸小液滴和硝酸小液滴,所以形成白雾,故答案为:产生白雾.
点评 本题考查三大强酸性质,为高频考点,明确这三种酸的通性及差异性是解本题关键,熟悉工业制取硝酸、硫酸原理及设备,注意浓硝酸和浓盐酸呈黄色区别,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 | |
| B. | 除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 | |
| C. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,取出有机层再分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤ | B. | ②④ | C. | ② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
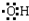 ;
;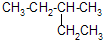 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷.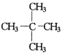 ;
; .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用足量饱和碳酸钠溶液水洗后分液 | B. | 用足量氢氧化钠溶液水洗后分液 | ||
| C. | 加入适量乙醇和浓硫酸加热 | D. | 加入金属钠充分反应后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用潮汐发电是将化学能转化为电能 | |
| B. | 海水蒸发制海盐的过程中只发生了化学变化 | |
| C. | 从海水中可以得到NaCl,电解熔融NaCl可制备Na | |
| D. | 海水中含有溴元素,只需经过物理变化就可以得到溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为氧化反应 | |
| B. | 上述反应中若产生0.1 mol SO42-,则消耗SO2的物质的量为0.1mol | |
| C. | Fe2(SO4)3、品红两种溶液都能使上述反应进行 | |
| D. | 通入Cl2会降低SO2的漂白作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com