
 ;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.
;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.分析 二氧化锰与浓盐酸发生反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,Mn元素化合价由+4价降低到+2价,Cl元素化合价由-1价升高;n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,结合方程式计算消耗10mol/L的浓盐酸的体积;氯气与氢氧化钠反应生成NaCl和NaClO,等物质的量的Cl2和SO2混合生成盐酸和硫酸,以此解答该题.
解答 解:氧化锰与浓盐酸发生反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,Mn元素化合价由+4价降低到+2价,Cl元素化合价由-1价升高,所以该反应的电子转移方向和数目可表示为 ,反应中MnO2为氧化剂,氧化产物为Cl2,氧化剂氧化性大于氧化产物,则MnO2氧化性较强,反应中盐酸起到酸性和还原剂的作用,n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,由方程式可知消耗0.4mol盐酸,则至少需要10mol/L的浓盐酸的体积为$\frac{0.4mol}{10mol/L}$=0.04L=40mL;
,反应中MnO2为氧化剂,氧化产物为Cl2,氧化剂氧化性大于氧化产物,则MnO2氧化性较强,反应中盐酸起到酸性和还原剂的作用,n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,由方程式可知消耗0.4mol盐酸,则至少需要10mol/L的浓盐酸的体积为$\frac{0.4mol}{10mol/L}$=0.04L=40mL;
将2.24升标准状况下的氯气通入足量的NaOH溶液,其反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,该反应中氧化剂和还原剂的物质的量之比为1:1,转移0.1NA电子;
SO2和Cl2在溶液中发生了氧化还原反应,生成硫酸和盐酸,由电子、电荷守恒可知离子反应为SO2+Cl2+2H2O═4H++SO42-+2Cl-,将等物质的量的Cl2和SO2混合通入品红溶液中,品红不褪色,
故答案为: ;MnO2;Cl2;MnO2;酸、还原剂;40;Cl2+2OH-═Cl-+ClO-+H2O;1:1;0.1NA;不褪色;SO2+Cl2+2H2O═4H++SO42-+2Cl-.
;MnO2;Cl2;MnO2;酸、还原剂;40;Cl2+2OH-═Cl-+ClO-+H2O;1:1;0.1NA;不褪色;SO2+Cl2+2H2O═4H++SO42-+2Cl-.
点评 本题综合考查氧化还原反应,侧重于氯气的性质的考查,为高频考点,注意氯气的实验室制法和氯气的性质、氧化还原反应的规律以及根据氧化还原反应方程式进行计算,解题关键在于明确实验室制备氯气的原理和氯气的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A的一种同分异构体B,它能和Na2CO3溶液反应生成CO2,则B的结构简式为CH3COOH;A的另一种同分异构体C,在酸性条件下水解得到D和E,且D和E的相对分子质量相同,写出C发生此水解反应的化学方程式:
,A的一种同分异构体B,它能和Na2CO3溶液反应生成CO2,则B的结构简式为CH3COOH;A的另一种同分异构体C,在酸性条件下水解得到D和E,且D和E的相对分子质量相同,写出C发生此水解反应的化学方程式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤粉碎,增大固体的表面积可以有效加快煤燃烧的速率 | |
| B. | 空气过量有利于煤充分燃烧,因此鼓入空气的量越多约好 | |
| C. | 可以用在煤中加入生石灰,减少SO2气体的排放 | |
| D. | 煤的气化可以使煤发生化学反应转化为水煤气等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl-) | |
| C. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO3-)+2c(H2CO3)+2c(CO32-) | |
| D. | pH=1的NaHSO4溶液:c(H+)═2c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
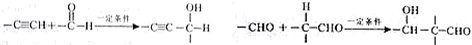

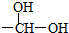 极不稳定,会自动脱水),其中核磁共振氢谱中只出现三组峰的是CH3CH(OH)CH(OH)CH3(写出结构简式).
极不稳定,会自动脱水),其中核磁共振氢谱中只出现三组峰的是CH3CH(OH)CH(OH)CH3(写出结构简式).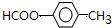 (写出结构简式).
(写出结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaHSO3溶液:c(H+)-c(OH-)═c(SO32-)-2(H2SO3) | |
| B. | 1 L 0.1 mol•L-1的(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| D. | 向0.01 mol•L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(SO42-)>c(Na+)═c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NH4+、PO43-、Cl- | B. | AlO2-、K+、I-、HCO3- | ||
| C. | K+、Fe2+、NO3-、[Fe(CN)6]3- | D. | Na+、Fe3+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在t℃时,饱和Ag2CrO4溶液中,若增大c(CrO42-),则银离子浓度增大 | |
| B. | 在t℃时,Ag2CrO4的Ksp为1×10-12 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 | |
| D. | 在t℃时,Y、Z两点处Ag2CrO4的溶度积常数前者大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com