
在一定条件下的反应N2(g)+ 3 H2(g)  2NH3(g) △H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是
2NH3(g) △H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是
A.升温 B.减压 C.加压 D.加催化剂
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:2016-2017学年河北省邢台市高二上学期第四次月考化学卷(解析版) 题型:推断题
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌、鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:

(1)火焰利用了部分金属元素特征的________反应,该反应属于_________(填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含的电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为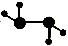 ,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,两元素的原子序数之比为2∶1。
,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,两元素的原子序数之比为2∶1。
①B的水溶液呈弱酸性,其主要的电离方程式可表示为________________,D的化学式是_____________。
②A、B、E中均含有的一种元素为____________(填元素名称)。
③E的电子式为______________。
④NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸发生反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:填空题
Ⅰ.CO2和CH4是两种重要的温室气体,通过CH4和CO2的反应,制造更高价值的化学品是目前的研究目标。250℃时,以镍合金为催化剂,发生如下反应:CO2(g)+CH4(g)?2CO (g)+2H2(g)
(g)+2H2(g)
(1)此温度下该反应的平衡常数表达式K= 。
(2)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=﹣890.3kJ•mol﹣1
② CO(g)+H2O(g)═CO2(g)+H2(g) △H=+2.8kJ•mol﹣1
③2CO(g)+O2(g)═2CO2(g) △H=﹣566.0kJ•mol﹣1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H= kJ•mol﹣1;
2CO(g)+2H2(g)的△H= kJ•mol﹣1;
(3)利用上述反应①设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式 。
Ⅱ.能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g) △H。
下表所列数据是该反应在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
(1)根据表中数据可判断△H 0 (填“>”、“=”或“<”).
(2)300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将 (填序号):A正向移动 B逆向移动 C处于平衡状态 D无法判断
(3)下列能说明上述反应达到化学平衡状态的标志是
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:选择题
下列溶液一定呈中性的是
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L的溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:选择题
一定量的的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可向稀H2SO4中加入
A.CH3COONa固体 B.Na2SO4固体 C.少量NH4HSO4固体 D. NaOH固体
查看答案和解析>>
科目:高中化学 来源:2017届吉林长春外国语学校高三上期末化学试卷(解析版) 题型:填空题
甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) =CH3OH(g)。
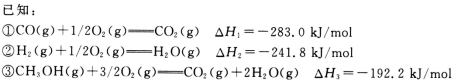
(1)计算CO(g)+2H2(g)=CH3OH(g)的反应热△H4=____________。
(2)为了提高燃料的利用率可以将甲醇设计为燃料电池,并用以此为电源进行电解实验,装置如图所示,回答相关问题。
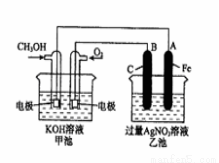
①写出通甲醇一极的电极反应方程式 ;写出乙池中B(C)电极的电极反应式 ;
②反应过程中,乙池溶液pH的变化为 (升 高、降低或不变)
③当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:推断题
【化学——选修3:物质结构与性质】原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)W+的电子排布式为 ,Y2X2分子中 键与π键数之比为 。
键与π键数之比为 。
(2)化合物ZX3比YX4易液化,主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物分子的结构式是 。
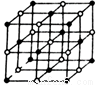
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ;如果该晶体的密度为d g·cm--3,阿伏加德罗常数为NA,则晶体中两个距离最近的氯离子中心间的距离为 cm。
(5)ZX3的VSEPR构型为 ,ZF3分子的空间构型为 ;ZX3容易与W2+形成配离子,但ZF3不易与W2+形成配离子,其原因是 _。
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
关于下图所示两个装置的叙述中不正确的是

A.c(H+)浓度变化:①减小,②减小
B. 装置名称:①是电解池,②是原电池
C.离子移动方向:①中H+向阴极方向移动,②中H+向正极方向移动
D. 电极反应式:①中阳极:2H2O-4e-=4H++O2↑,②中负极中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com