

·ÖĪö ¹¤ŅµÉś²śĪŽĢśĮņĖįĀĮ£¬ŅŌĮņĖį½žČ”ĀĮĶĮæóµĆŗ¬Ģś£ØFe2+ŗĶFe3+£©µÄĮņĖįĀĮČÜŅŗ£¬¼ÓČȵ½Ņ»¶ØĪĀ¶Č£¬½Į°č£¬¼ÓČėŅ»¶ØĮæøßĆĢĖį¼ŲČÜŅŗŗĶĮņĖįĆĢČÜŅŗ£¬ŌŚČÜŅŗÖŠÉś³É»īŠŌ¶žŃõ»ÆĆĢ£¬µ÷½ŚČÜŅŗµÄpH£¬·“Ó¦Ņ»¶ĪŹ±¼ä£¬Fe£ØOH£©3ŗĶ¶žŃõ»ÆĆĢ·¢ÉśĪüø½¹²³Į×÷ÓĆ£¬×īÖÕµĆµ½ĪŽĢśĮņĖįĀĮ²śĘ·£»
£Ø1£©KMnO4Ź×ĻČ½«Fe2+Ńõ»ÆĪŖFe3+£¬Ęä±¾Éķ±»»¹ŌĪŖMnO2£¬ŅĄ¾ŻŌ×ÓŹŲŗćŗĶµēŗÉŹŲŗćŹéŠ“Ąė×Ó·½³ĢŹ½£»
£Ø2£©øł¾ŻŃõ»Æ»¹Ō·“Ó¦ÖŠ»ÆŗĻ¼ŪÉż½µĻąµČ£¬æÉŠ“³ö»Æѧ·½³ĢŹ½ĪŖ2KMnO4+3MnSO4+2H2O=5MnO2”ż+K2SO4+2H2SO4£»½įŗĻĄė×Ó·½³ĢŹ½ŗĶ»Æѧ·½³ĢŹ½¶ØĮæ¹ŲĻµ¼ĘĖć£»
£Ø3£©ĢśĄė×ÓŅ×·¢ÉśĖ®½ā·“Ӧɜ³ÉĒāŃõ»ÆĢś£»
£Ø4£©²Ł×÷1ĪŖ¹żĀĖ£¬²Ł×÷2ĪŖÕō·¢½į¾§£®
½ā“š ½ā£ŗ£Ø1£©KMnO4Ź×ĻČ½«Fe2+Ńõ»ÆĪŖFe3+£¬Ęä±¾Éķ±»»¹ŌĪŖMnO2£¬ŅĄ¾ŻŌ×ÓŹŲŗćŗĶµēŗÉŹŲŗćŹéŠ“Ąė×Ó·½³ĢŹ½ĪŖ£ŗMnO4-+3Fe2++4H+=3Fe3++MnO2+2H2O£¬
¹Ź“š°øĪŖ£ŗMnO4-+3Fe2++4H+=3Fe3++MnO2+2H2O£»
£Ø2£©ÓÉĢāŅāæÉÖŖøßĆĢĖį¼ŲČÜŅŗŗĶĮņĖįĆĢČÜŅŗ·“Ӧɜ³É»īŠŌ¶žŃõ»ÆĆĢ£¬øł¾ŻŃõ»Æ»¹Ō·“Ó¦ÖŠ»ÆŗĻ¼ŪÉż½µĻąµČ£¬æÉŠ“³ö»Æѧ·½³ĢŹ½ĪŖ2KMnO4+3MnSO4+2H2O=5MnO2”ż+K2SO4+2H2SO4£¬ČōČÜŅŗÖŠŃĒĢśĄė×ÓŗĶĢśĄė×ÓÅØ¶Č¾łĪŖ0.03mol/L£¬ČÜŅŗÖŠŗ¬ÓŠFe2+ĪļÖŹµÄĮæĪŖ0.03mol£¬µ÷½ŚČÜŅŗPHŹ¹ĢśĄė×ÓČ«²æ³Įµķ£¬n£ØFe£©=0.06mol
MnO4-+3Fe2++4H+=3Fe3++MnO2+2H2O£¬
0.01mol 0.03mol 0.01mol
n£ØMnO2£©/n£ØFe£©æŲÖĘŌŚ4£ŗ1Ź±£¬³żĢśŠ§¹ū½ĻŗĆ£®Ōņn£ØMnO2£©=0.06mol”Į4=0.24mol£»
·“Ó¦ÖŠÉś³É¶žŃõ»ÆĆĢĪļÖŹµÄĮæ=0.24mol-0.01mol=0.23mol£¬ĻūŗÄøßĆĢĖį¼ŲĪļÖŹµÄĮæ£ŗ
2KMnO4+3MnSO4+2H2O=5MnO2”ż+K2SO4+2H2SO4£¬
2 5
n 0.23mol
n=0.092mol£¬
ĪŖ“ļµ½½ĻŗĆµÄ³żĢśŠ§¹ū£¬Ćæ1LČÜŅŗÓ¦¼ÓČėøßĆĢĖį¼ŲµÄĪļÖŹµÄĮæ=0.092mol+0.01mol=0102mol£»
¹Ź“š°øĪŖ£ŗ2KMnO4+3MnSO4+2H2O=5MnO2”ż+K2SO4+2H2SO4£»0.102mol£»
£Ø3£©ĢśĄė×ÓŅ×·¢ÉśĖ®½ā·“Ӧɜ³ÉĒāŃõ»ÆĢś£¬µ±µ÷½ŚČÜŅŗPH£¬Ź¹ČÜŅŗPHŌö“óŹ±£¬Ņ׏¹ĢśĄė×Ó×Ŗ»ÆĪŖĒāŃõ»ÆĢś³Įµķ³żČ„£¬
¹Ź“š°øĪŖ£ŗŹ¹ĢśĄė×Ó×Ŗ»ÆĪŖĒāŃõ»ÆĢś³Įµķ³żČ„£»
£Ø4£©øł¾ŻĢāÖŠŠÅĻ¢£¬·“Ó¦Ņ»¶ĪŹ±¼ä£¬¶žŃõ»ÆĆĢŗĶFe £ØOH£© 3·¢ÉśĪüø½¹²³Į×÷ÓĆ£¬æÉÖŖ²Ł×÷1ĪŖ¹żĀĖ£¬²Ł×÷2ĪŖ¹żĀĖŗó£¬ĀĖŅŗÕō·¢ÅØĖõ£¬ĄäČ“½į¾§£¬¹żĀĖĻ“µÓ£»
¹Ź“š°øĪŖ£ŗ¹żĀĖ£»Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖĻ“µÓ£®
µćĘĄ ±¾Ģāæ¼²é½ĻĪŖ×ŪŗĻ£¬Éč¼ĘĪļÖŹµÄÖʱøĮ÷³Ģ”¢Ąė×Ó·½³ĢŹ½µÄŹéŠ“”¢Ńõ»Æ»¹Ō·“Ó¦”¢ĪļÖŹµÄ·ÖĄėŗĶĢį“æµČĪŹĢā£¬µ«ĢāÄæÄѶČÖŠµČ£¬±¾Ģā×¢Ņā°ŃĪÕÖʱøŌĄķŗĶŹµŃéĮ÷³Ģ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŃĪĖį”¢ĮņĖįŗĶĻõĖįŹĒ֊ѧ½×¶Ī³£¼ūµÄ”°Čż“óĖį”±£®ĻÖ¾ĶĮņĖį”¢ĻõĖįÓė½šŹōĶ·“Ó¦µÄĒéæö£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
ŃĪĖį”¢ĮņĖįŗĶĻõĖįŹĒ֊ѧ½×¶Ī³£¼ūµÄ”°Čż“óĖį”±£®ĻÖ¾ĶĮņĖį”¢ĻõĖįÓė½šŹōĶ·“Ó¦µÄĒéæö£¬»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¶žŌŖČõĖįĖįŹ½ŃĪNaHAČÜŅŗÖŠ£ŗc£ØH+£©+c£ØNa+£©=c£ØOH-£©+c£ØHA-£©+c£ØA2-£© | |
| B£® | Ņ»¶ØĮæµÄ£ØNH4£©2SO4ÓėNH3•H2O»ģŗĻµÄĖįŠŌČÜŅŗÖŠ£ŗc£ØNH4+£©£¾2c£ØSO42-£© | |
| C£® | ĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.01mol/LµÄCH3COOHŗĶCH3COONaµÄČÜŅŗµČĢå»ż»ģŗĻŗóČÜŅŗÖŠ c£ØCH3COOH£©+c£ØCH3COO-£©=0.02 mol/L | |
| D£® | ĪļÖŹµÄĮæÅضČĻąµČµÄ¢ŁNH4HSO4ČÜŅŗ”¢¢ŚNH4HCO3ČÜŅŗ”¢¢ŪNH4ClČÜŅŗÖŠc£ØNH4+£©£ŗ¢Ł£¾¢Ū£¾¢Ś |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
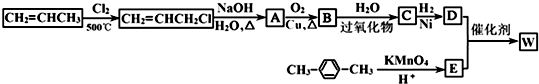
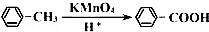
 £®
£® ”ś
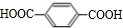
”ś +2H2O£®
+2H2O£®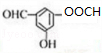 £®
£® £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ŹŅĪĀĻĀ£¬½«1.000mol•L-1ŃĪĖįµĪČė20.00mL 1.000mol•L-1°±Ė®ÖŠ£¬ČÜŅŗpHŗĶĪĀ¶ČĖę¼ÓČėŃĪĖįĢå»ż±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£®ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
ŹŅĪĀĻĀ£¬½«1.000mol•L-1ŃĪĖįµĪČė20.00mL 1.000mol•L-1°±Ė®ÖŠ£¬ČÜŅŗpHŗĶĪĀ¶ČĖę¼ÓČėŃĪĖįĢå»ż±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£®ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | aµćĖ®µÄĄė×Ó»żKw=1.0”Į10-14 | |
| B£® | bµć£ŗc£ØNH4+£©+c£ØH+£©=c£ØCl-£©+c£ØOH-£© | |
| C£® | cµć£ŗc£ØCl-£©=c£ØNH4+£© | |
| D£® | dµćŗó£¬ČÜŅŗĪĀ¶ČĀŌĻĀ½µµÄÖ÷ŅŖŌŅņŹĒNH3•H2OµēĄėĪüČČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | pH=12µÄNaOHČÜŅŗ¼ÓĖ®Ļ”ŹĶ100±¶£¬ČÜŅŗpH=10 | |
| B£® | pH=5µÄŃĪĖįČÜŅŗĻ”ŹĶ1000±¶£¬ČÜŅŗµÄpHŌ¼µČÓŚ7 | |
| C£® | pH=2µÄ H2SO4ÓėpH=12µÄNaOHČÜŅŗµČĢå»ż»ģŗĶ£¬ČÜŅŗpH=7 | |
| D£® | pH=12µÄNH3•H2OÓėpH=2µÄHClČÜŅŗµČĢå»ż»ģŗĶ£¬»ģŗĶŅŗpH£¼7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 N”¢P”¢As”¢Ga”¢CrµČŌŖĖŲ»ÆŗĻĪļÖÖĄą·±¶ą£¬¾ßÓŠÖŲŅŖµÄŃŠ¾æ¼ŪÖµŗĶÓ¦ÓĆ¼ŪÖµ£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
N”¢P”¢As”¢Ga”¢CrµČŌŖĖŲ»ÆŗĻĪļÖÖĄą·±¶ą£¬¾ßÓŠÖŲŅŖµÄŃŠ¾æ¼ŪÖµŗĶÓ¦ÓĆ¼ŪÖµ£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś | B£® | ¢Ś | C£® | ¢Ū¢Ü | D£® | ¢Ü¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com