
(8分)写出下列反应的离子方程式
(1)含少量NaHCO3的溶液与含过量Ba(OH)2的溶液混合: ;
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式 ;
(3)硫酸铜溶液和氢氧化钡溶液混合
(4)用醋酸除去水壶中的水垢
(1)HCO3-+OH-+Ba2+===BaCO3↓+H2O
(2)2H++SO42—+2OH-+Ba2+===BaSO3↓+2H2O
(3)Cu2++SO42—+2OH-+Ba2+===BaSO3↓+Cu(OH)2↓;
(4)CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O
解析试题分析:(1)含少量NaHCO3的溶液与含过量Ba(OH)2的溶液混合,“以少定多”;即用HCO3-定Ba2+和OH-的计量数:HCO3-+OH-+Ba2+===BaCO3↓+H2O。
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,Ba(OH)2做标准,即Ba2++2OH-定H+和Ba2+的计量数:2H++SO42—+2OH-+Ba2+===BaSO3↓+2H2O;
(3)硫酸铜溶液和氢氧化钡溶液混合只有:Cu2++SO42—+2OH-+Ba2+===BaSO3↓+Cu(OH)2↓;
(4)醋酸是弱酸,不能拆开,水壶中的水垢主要为CaCO3固体。
考点:离子方程式的书写。


科目:高中化学 来源: 题型:单选题
下列各组离子在溶液中能够大量共存的是
| A.NH4+、Ca2+、OHˉ、CO32ˉ |
| B.Ag+、H+、SO32ˉ、ClOˉ |
| C.NH4+、Brˉ、Na+、SO42ˉ |
| D.H+、Clˉ、Fe2+、NO3ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子能够大量共存,且满足相应要求的是
| 选项 | 离 子 | 要 求 |
| A | NH、Al3+、SO、H+ | 滴加NaOH溶液立刻有气体产生 |
| B | K+、NO、Cl-、HS- | c(K+)<c(Cl-) |
| C | Fe2+、NO、SO、Cl- | 逐滴滴加盐酸时溶液没有颜色变化 |
| D | Na+、HCO、Mg2+、SO | 滴加氨水立即有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:根据以上信息,回答下列问题: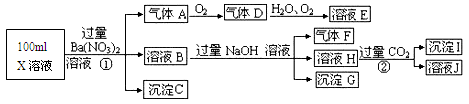
(1)气体F为____________。
(2)上述离子中,溶液X中除H+外还肯定含有的离子是_______,不能确定是否含有的离子是____。
(3)写出生成A的离子方程式:_________________。
(4)通常可以利用KClO在碱性条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能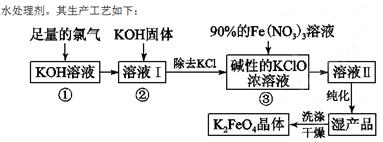
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)有一瓶澄清的溶液,其中可能含有NH4+、K+、 Ba2+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2- 。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 离子的存在。
(2)由②可以证明 离子的存在,同时排除 离子存在。理由是_________________________。
(3)由③可证明 离子存在。
(4)由④可以排除 离子存在,同时证明 离子的存在。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下: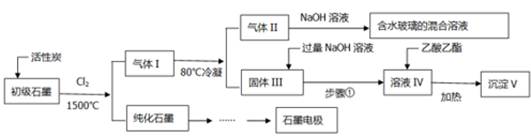
(注:SiCl4的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化学方程式为 。
(3)步骤①为:搅拌、 。所得溶液IV中阴离子有 。
(4)由溶液IV生成沉淀V的总反应的离子方程式为 。100kg初级石墨最多可获得V的质量为kg 。
(5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为 ;在加高锰酸钾溶液前,若pH较低,对除杂的影响是 。
(2)反应③的反应类型为 ,过滤得到的滤渣中,除了过量的锌外还有 。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是 。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2取干操后的滤饼11.2g,煅烧后可得到产品8.1g,则x等于 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.高铁酸钾(K2FeO4)是极好的氧化剂,具有高效的消毒作用,为一种新型非氯高效消毒剂。其生产工艺流程如下: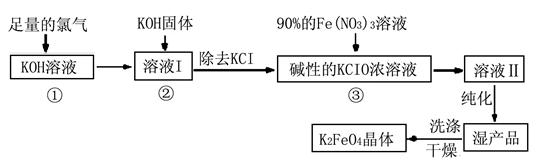
请同答下列问题。
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式 。
(2)在溶液I中加入KOH固体的目的是 (选填序号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解会放出较多的热量,有利于提高反应速率和KClO的纯度 |
 3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com