
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为_________。
(2)可以区别甲烷和乙烯的试剂是_________(填正确选项的编号)。
A.浓硫酸 B.碳酸钠溶液 C.溴的四氯化碳溶液 D.酸性高锰酸钾溶液
(3)CH3CH3可以通过乙烯和_________反应生成。
(4)已知 2CH3CHO+ O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下所示:
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下所示:
反应②的化学方程式为______________________。
工业上以乙烯为原料生产聚乙烯的化学方程式为_________,反应类型属于_______。
【答案】 H2C=CH2 CD H2或氢气 2CH3CH2OH+O2![]() 2CH3CHO+2H2O nCH2=CH2
2CH3CHO+2H2O nCH2=CH2![]()
![]() 加聚反应或聚合反应
加聚反应或聚合反应
【解析】(1)乙烯的结构简式为CH2=CH2,故答案为: CH2=CH2;
(2)A.浓硫酸与甲烷和乙烯都不反应,不能区分,故A错误;B.碳酸钠溶液与甲烷和乙烯都不反应,不能区分,故B错误;C.乙烯能够使溴的四氯化碳溶液褪色,而甲烷不能,可以区分,故C正确;D.乙烯能够使酸性高锰酸钾溶液褪色,而甲烷不能,可以区分,故D正确;故选CD;
(3)乙烯能够与氢气加成反应生成CH3CH3,故答案为:氢气;
(4)以乙烯为主要原料合成乙酸,根据合成路线,乙烯与水加成生成乙醇,乙醇被氧化生成乙醛,乙醛再氧化生成乙酸。反应②的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,乙烯发生加聚反应生成聚乙烯的化学方程式为nCH2=CH2
2CH3CHO+2H2O,乙烯发生加聚反应生成聚乙烯的化学方程式为nCH2=CH2![]()
![]() ,故答案为:2CH3CH2OH+O2
,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;nCH2=CH2
2CH3CHO+2H2O;nCH2=CH2![]()
![]() ;加聚反应或聚合反应。
;加聚反应或聚合反应。


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】镓(Ga)与铝位于同一主族,金属镓的熔点是29. 8℃,沸点是2403℃,是一种广泛用于电子工业和通讯领域的重要金属。
(1)工业上利用镓与NH3在1000℃高温下合成固体半导体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.27 kJ热量。
写出该反应.的热化学方程式___________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。

①图1中A点和C点化学平衡常数的大小关系是:KA_____ KC,(填“<”“=”或“>”),理由是____________。
②在T1和P6条件下反应至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(34 min的浓度变化未表示出来),则改变的条件为________(仅改变温度或压强中的一种)。
(3)气相平衡中用组份的平衡分压(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),用含P6的式子表示B点的Kp=_____________。
(4)电解精炼法提纯嫁的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质,在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+3+2+2+。电解精炼镓时阳极泥的成分是________________。
②镓在阳极溶解生成的Ga3+与.NaOH溶液反应生成GaO2-,该反应的离子方程式为_________________;
GaO2-在阴极放电的电极反应式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式____________。
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4-中B原子的杂化类型为____________;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子化学式为_________________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色),两者配位数_____(填“相同”或“不同”),绿色晶体中配体是______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为____________。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为![]() g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是中学化学实验室的常见药品,回答下列实验问题。
Ⅰ.配制一定物质的量浓度的硫酸溶液:
(1)某次实验大约需要1mol/L硫酸溶液435ml。同学们发现实验室内没有450ml的容量瓶,某同学提议用1个200ml容量瓶和1个250ml容量瓶来配制,你认为该提议_________(填“合理”、“不合理”)。
(2)实验中要配制0.5mol/L H2SO4溶液250ml。则需量取密度为1.84g/ml、98%的浓硫酸________ml。
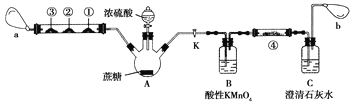
Ⅱ.蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,会对环境造成污染。某实验小组利用如下装置对该实验进行改进。回答下列问题:
注:硬质玻璃管中①、②、③处分别为滴有Na2S溶液的滤纸、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
(1)图中盛装浓硫酸的仪器名称为________________。
(2)实验开始后先关闭活塞K,硬质玻璃管中①号试纸变黄,②号和③号滤纸均褪色,a处气球变大。硬质玻璃管中实验现象说明炭化实验产生的刺激性气味气体是SO2,①、②、③处发生的变化分别说明SO2具有_____________、_____________和_____________(填SO2表现出的性质)。
(3)打开活塞K,a处气球变小,b处气球变大。使三颈烧瓶内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊。为证明有CO2生成,可以在④号位置的滤纸滴加______________溶液,该试剂的作用是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,环境问题越来越引起人们的重视。温室效应、酸雨、臭氧层被破坏、赤潮等已经给我们赖以生存的环境带来较大的影响,造成酸雨的主要有害物质是
A. CO2B. 硫和氮的氧化物
C. 含氟化合物D. 化肥和含磷洗衣粉的使用及其污水的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中会排放出酸性废水。含石TiO2+、Fe2+、Fe3+离子,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)写出步骤Ⅰ发生反应的离子方程式___________。
(2)步骤Ⅰ后所得溶液中Fe2+的检验方法是___________。
(3)从溶液中得到FeSO4·7H2O的操作是___________、___________、过滤、洗涤。步骤Ⅲ中反应温度一般需控制在35℃以下,其目的是___________。
(4)步骤Ⅳ发生反应的化学方程式为___________。
(5)步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中___________(填“有”或“没有”)(己知Fe(OH)2(已知Fe(OH)2的Ksp为8×10-16)
(6)向“富TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请用化学原理解释其原因。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向盛有50 mL pH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是
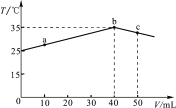
A. a→b的过程中,溶液中c(A-)与c(HA)之和始终不变
B. c点表示酸碱恰好完全反应
C. 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D. 25 ℃时,HA的电离平衡常数Ka约为1.43×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置制取乙酸乙酯。请回答下列问题。

(1)反应开始前试管B中加入的试剂是_______,反应结束后试管B中上层液体的主要成分是________。
(2)向试管A中加入试剂时,浓硫酸应在加入乙醇之后再加入,目的是___________。
(3)制取乙酸乙酯的化学方程式为_______________。
(4)插入试管B中的干燥管的作用是_______________。
(5)从试管B中分离出粗产品乙酸乙酯(含乙酸,乙醇和水),采用的分离方法是________,使用CaO可以除去粗产品中的________杂质,最后采用________的方法可得到较纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com