
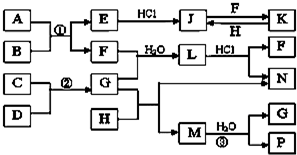
 如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).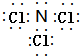 ,故答案为:SO2;NH4+;
,故答案为:SO2;NH4+;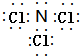 ;
;

科目:高中化学 来源: 题型:
 使用氯化钠作原料可以得到多种产品.
使用氯化钠作原料可以得到多种产品.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4 mol.L-1 |
| B、0.2 mol.L-1 |
| C、0.3 mol.L-1 |
| D、0.05mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑦ | B、②⑥⑧ |
| C、①④⑥ | D、全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
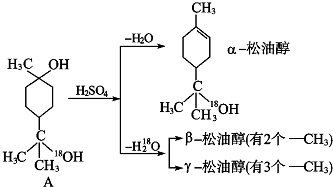
查看答案和解析>>
科目:高中化学 来源: 题型:
 酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.查看答案和解析>>
科目:高中化学 来源: 题型:
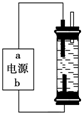
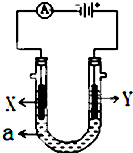 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com