
分析 原电池反应中负极是锌,电极反应为Zn-2e-=Zn2+;铜做正极,溶液中铜离子得到电子生成铜发生还原反应,电极反应Cu2++2e-=Cu;铜片质量增加了12.8g,且溶液恰好变为无色.假设锌片上没有铜析出,说明溶液中铜离子全部析出,依据电极反应和电子守恒计算.
解答 解:负极是金属锌,电极反应为Zn-2e-=Zn2+;铜做正极,溶液中铜离子得到电子生成铜发生还原反应,电极反应Cu2++2e-=Cu,铜片质量增加了12.8g,且溶液恰好变为无色.假设锌片上没有铜析出,说明溶液中铜离子全部析出,
(1)铜片是原电池的正极,故答案为:正极;
(2)负极反应:Zn-2e-=Zn2+;正极反应:Cu2++2e-=Cu,铜片质量增加了12.8g,物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,依据电子守恒,Zn~Cu~2e-,溶解的锌质量=0.2mol×65g/mol=13g,
故答案为:13;
(3)依据(1)计算可知转移电子总数为0.4mol,
故答案为:0.4;
(4)铜片质量增加了12.8g,且溶液恰好变为无色.假设锌片上没有铜析出,说明溶液中铜离子全部析出,原溶液中铜离子物质的量为0.2mol,溶液浓度=$\frac{0.2mol}{0.1L}$=2mol/L,故答案为:2.
点评 本题考查了原电池原理分析,电极反应书写计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
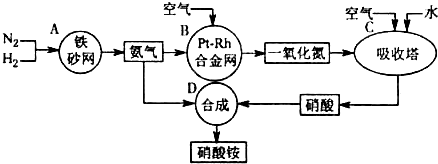
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
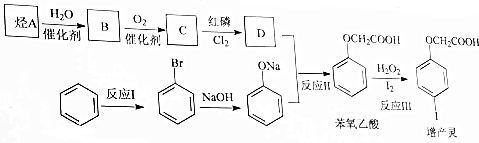
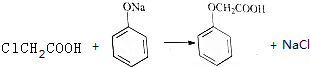 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
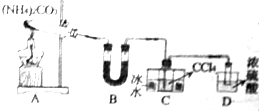 尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.
尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
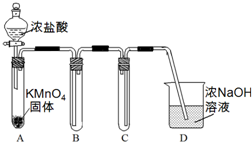 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | 6mL | 3mL | 0mL |
| 硫酸(6mol/L) | 0mL | 2mL | (5)mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, 生成黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N4是N2的同素异形体 | |
| B. | 等质量的N4和N2,N4体积是N2体积的一半 | |
| C. | 相同质量的N4和N2所含原子个数比为1:2 | |
| D. | N4的摩尔质量是56g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com