
【题目】常温下,向0.1mol/L的AlCl3溶液中不断加入NaOH溶液,体系中含铝微粒的分布分数随溶液pH的变化如图所示。下列说法错误的是

A.pH=4的溶液中:c(Al3+)>c[Al(OH)2+]>c[Al(OH)2+]
B.pH=4.5的溶液中:c(H+)+3c(Al3+)+2c[Al(OH)2+]+c[Al(OH)2+]=c(Cl-)+c(OH-)
C.pH=7时,向体系中再加入NaOH溶液,主要发生的离子反应为Al(OH)3+OH-=Al(OH)4-
D.pH=8时,向得到的溶液中通入CO2至饱和,主要发生的离子反应为2Al(OH)4-+CO2=2Al(OH)3↓+CO32-+H2O,CO32-+CO2+H2O=2HCO3-
【答案】B
【解析】
A.根据图像可知,pH=4的溶液中:c(Al3+)>c[Al(OH)2+]>c[Al(OH)2+],A正确;
B.pH=4.5的溶液中,根据溶液呈电中性,则c(Na+)+c(H+)+3c(Al3+)+2c[Al(OH)2+]+c[Al(OH)2+]=c(Cl-)+c(OH-),B错误;
C.pH=7时,向体系中再加入NaOH溶液,根据图像可知,氢氧化铝的百分含量降低,c[Al(OH)4-]升高,主要发生的离子反应为Al(OH)3+OH-=Al(OH)4-,C正确;
D.pH=8时,溶液中主要为Al(OH)4-,向得到的溶液中通入CO2至饱和,主要发生的离子反应为2Al(OH)4-+CO2=2Al(OH)3+CO32-+H2O,CO32-+CO2+H2O=2HCO3-,D正确;
答案为B。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是 ( )

A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO42—
D.此工艺的优点之一是物质能循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

(1)写出基态时Q元素原子的电子排布式__________,J元素原子的外围电子排布图________________。
(2)下列对比正确的是__________。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(3)关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是______。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
Ⅱ、已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(4)F、G元素对应的最高价含氧酸中酸性较强的化学式为__________。
(5)第一电离能:B__________C,电负性:C__________F。(填“<”、“>”或“=”)
(6)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为____________,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式__________。
(7)写出E与D的最高价氧化物对应的水化物反应的化学方程式______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素质量的关系曲线,如图2所示。则下列分析正确的是( )
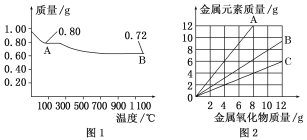
A. 图1中,A到B的过程中有0.005 mol电子发生了转移
B. 图1整个过程中共生成0.18 g水
C. 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D. 图1中A和B化学式分别为Cu2O和CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.将铜片插入稀硝酸中:![]()
B.稀硫酸与Ba(OH)2溶液反应:![]()
C.向A12(SO4)3溶液中加入过量氨水:![]()
D.向Na2SiO3溶液中滴加醋酸:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (15分)研究证明,高铁酸钾不仅能在饮用水源和废水处理过程中去除污染物,而且不产生任何诱变致癌的产物,具有高度的安全性。湿法制备高铁酸钾是目前最成熟的方法,实验步骤如下:
A.直接用天平称取60.5gFe(NO3)3·9H2O、30.0gNaOH、17.1gKOH。
B.在冰冷却的环境中向NaClO溶液中加入固体NaOH并搅拌,又想其中缓慢少量分批加入Fe(NO3)3·9H2O,并不断搅拌。C.水浴温度控制在20℃,用电磁加热搅拌器搅拌1.5h左右,溶液成紫红色时,即表明有Na2FeO4生成。
D.在继续充分搅拌的情况下,向上述的反应液中加入固体NaOH至饱和。
e.将固体KOH加入到上述溶液中至饱和。保持温度在20℃,并不停的搅拌15min,可见到烧杯壁有黑色沉淀物生成,即K2FeO4.
(1)①步骤b中不断搅拌的目的是_______。②步骤c中发生反应的离子方程式为______。③由以上信息可知:高铁酸钾的溶解度比高铁酸钠_______(填“大”或“小”)。
(2) 高铁酸钾是一种理想的水处理剂,与水反应生成O2、Fe(OH)3(胶体)和KOH。① 该反应的离子方程式为______。②高铁酸钾作为水处理剂发挥的作用是_______。③ 在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______。
A.H2O B.稀KOH溶液、异丙醇 C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(3) 高铁酸钠还可以用电解法制得,其原理可表示为Fe+2NaOH+2H2O![]() 3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
(4)25℃时,Ksp(CaFeO4)=4.536×10-9,若要使100mL1.0×10-3mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,理论上要加入Ca(OH)2的物质的量为_____mol。
(5)干法制备高铁酸钾的方法是Fe2O3、KNO3、KOH混合加热共熔生成黑色高铁酸钾和KNO2等产物。则该方法中氧化剂与还原剂的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A和B,随着反应的进行,各物质的物质的量浓度变化如图所示。下列说法不正确的是
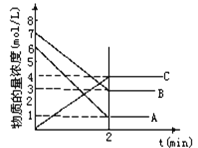
A.该反应的化学方程式为:5A+4B![]() 4C
4C
B.该反应达到平衡时,A、B、C的浓度比为5∶4∶4
C.用B的浓度变化表示2min内的速率为2 mol·L-1·min-1
D.2 min前,正反应速率逐渐减小,逆反应速率逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是( )
H+ + O22-)下列分析不正确的是( )

A.①、⑤中产生的气体能使带火星的木条复燃
B.①、④中均发生了氧化还原反应和复分解反应
C.②、⑤中KMnO4与MnO2的作用不同
D.通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构是:关于它的性质的描述正确的是( )
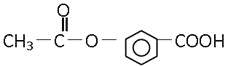
①能发生加成反应; ②能溶解于NaOH溶液中; ③能水解生成两种有机物;
④不能使溴水褪色; ⑤能发生酯化反应; ⑥有酸性
A. ①②③B. ②③⑤C. 仅⑥D. 全部正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com