
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50mL0.55mol?L-1 NaOH溶液 | 50mL0.5mol?L-1 HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol?L-1 NaOH溶液 | 50mL0.5mol?L-1 HCl溶液 | 20℃ | 23.5℃ | |
| Q |
| n |
| 3.3℃+3.5℃ |
| 2 |
| Q |
| n |
| 1.42 |
| 0.05×0.5 |


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
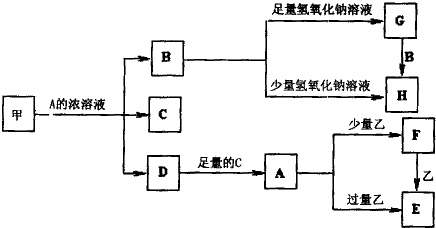
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、找到了新型高效催化剂 |
| B、充分利用了能量 |
| C、提高了纯碱产品的纯度 |
| D、有效减少了环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、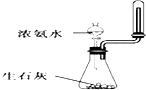 制取少量氨气 |
B、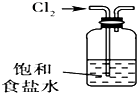 除去氯气中的HCl杂质 |
C、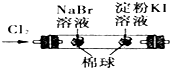 证明氧化性Cl2>Br2>I2 |
D、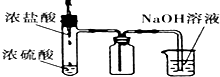 制取HCl且除去多余的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何条件下,纯水都呈中性 |
| B、pH<7的溶液一定呈酸性 |
| C、25℃时,纯水和稀酸溶液中水的离子积常数不相符 |
| D、pH均等于6的NH4Cl溶液和CH2COOH溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向无色溶液加入盐酸酸化的氯化钡溶液有白色沉淀,结论:溶液中含有SO42- |
| B、无色溶液焰色反应呈黄色,结论:溶液中含有Na+ |
| C、向无色试液加入硝酸酸化的硝酸银溶液产生白色沉淀,结论:溶液中含Cl-- |
| D、向某溶液中加入氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,结论:溶液中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| O2 |
| H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com