
【题目】配制100 mL 1.0 ![]()
![]() 的NaOH溶液,下列情况会导致溶液浓度偏低的是( )
的NaOH溶液,下列情况会导致溶液浓度偏低的是( )
A. 容量瓶使用前经蒸馏水清洗后没有干燥
B. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C. 俯视确定凹液面与刻度线相切
D. 用敞口容器称量NaOH且时间过长
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,一定温度下发生反应2N2O5(g)4NO2(g)+O2(g) ΔH>0, T1温度下的部分实验数据如下表所示。
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 该反应在任何温度下均能自发进行
B. T1温度下的平衡常数为K1=125,1 000 s时N2O5(g)转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维,该聚酯纤维的结构简式为 ,下列说法正确的是
,下列说法正确的是
A. 羊毛与该聚酯纤维的化学成分相同
B. 该聚酯纤维和羊毛在一定条件下均不能水解
C. 由单体合成该聚酯纤维的反应属于加聚反应
D. 合成该聚酯纤维的单体为对苯二甲酸和乙二醇
查看答案和解析>>
科目:高中化学 来源: 题型:
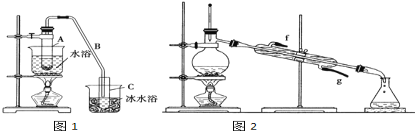
【题目】化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯。
已知:
相对分子质量 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 100 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 82 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品:
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是_________.
②试管C置于冰水浴中的目的是____________________________.
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静止、分层,环己烯在______层(填“上”或“下”),分液后用_______(填选项字母)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,蒸馏时要加入生石灰,目的是__________________________.
③蒸馏收集产品时,实验制得的环己烯精品质量低于理论产量,可能的原因是_______(填选项字母).
a. 蒸馏时从70℃开始收集产品 b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出。
(3)以下区分环己烯精品和粗品的方法,合理的是_______(填选项字母)。
a. 分别加入用金属钠 b. 分别加入酸性高锰酸钾溶液
c. 分别测定沸点 d. 分别加入FeCl3溶液
(4)如果最终得到纯净环己烯产品质量为8.2 g, 则该实验所得到的环己烯产率是___________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
元素 | Al | B | Be | C | Cl | F | Li |
X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
元素 | Mg | Na | O | P | S | Si | |
X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)请预测K与Rb元素的X数值的大小关系:K ______ Rb (填“>”、“=”或“<”)。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断AlBr3中的化学键类型是____。
(3)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于____原子(填元素符号).
(4)简述第二周期元素(除稀有气体外)的X的数值大小与原子半径之间的关系:________。
Ⅱ.(1)
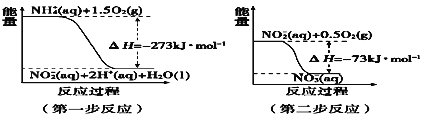
①第一步反应是____反应(选填“放热”或“吸热”),判断依据_____。
②1 molNH4+(aq)全部氧化成NO3- (aq)的热化学方程式_______。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
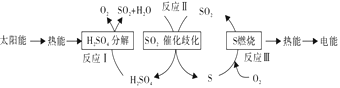
反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=297 kJ/mol
反应Ⅱ的热化学方程式:_______________。
(3)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH的量 | 放出的热量 |
22.0 g | 750 mL 1.0 mol/L | x kJ |
1.0 mol | 2.0 L 1.0 mol/L | y kJ |
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L1KI 溶液:Na+、K+、ClO 、OH
D. 常温下,![]() =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 常温下,78 g Na2O2中含有的阴离子数是2NA
B. 标况下,22.4 L CCl4含有的共价键数是4NA
C. 2.4g镁在足量氧气中燃烧,转移的电子数是0.1NA
D. 铁铝混合物与一定量稀盐酸反应生成1 mol H2时,转移电子数是2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
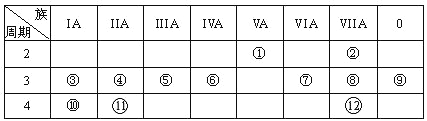
(1)画出原子的结构示意图:④______________
(2)在①~12元素中,金属性最强的元素是______,非金属性最强的元素是____,最不活泼的元素是_____。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)元素⑤的最高价氧化物的水化物分别与元素③⑧的最高价氧化物的水化物反应的离子方程式_________, _________
(5)第三周期中原子半径最大的元素跟它同周期原子半径最小的元素它们可以形成化合物,用电子式表示其形成过程:__________。
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程:______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com