


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
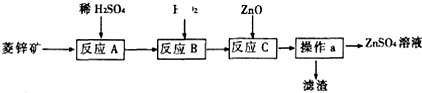
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.2 |
| Zn2+ | 6.2 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
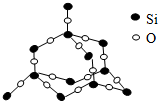 二氧化硅晶体是立体的网状结构.其晶体模型如图所示.认真观察晶体模型并回答下列问题:
二氧化硅晶体是立体的网状结构.其晶体模型如图所示.认真观察晶体模型并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+ K+ Cl- NO3- |
| B、K+ Al3+ Cl- CO32- |
| C、K+ Na+ CO32- NO3- |
| D、Al3+ Cu2+ SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
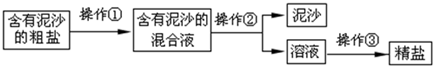
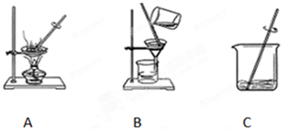
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝熔点高,因此可用作耐高温材料 |
| B、氢氟酸能与二氧化碳反应,因此可用于刻蚀玻璃 |
| C、碳化硅硬度大,因此可用作磨料 |
| D、碳酸钡能与盐酸反应,因此可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com