
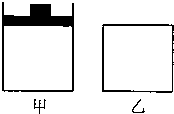
 将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生如下反应:2A(g)+2B(g)?3C(g);△H<0.下列说法不正确的是( )
将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生如下反应:2A(g)+2B(g)?3C(g);△H<0.下列说法不正确的是( )| A、在相同条件下两容器内的反应均达到化学平衡状态,升温时甲、乙两容器中反应速率均增大 | B、在相同条件下两容器内的反应均达到化学平衡状态,升温时甲乙两容器中的平衡均向逆方向移动 | C、在相同温度下,甲容器中加入2molA和2molB,乙容器中加入3molC,若甲容器经30s达到平衡状态,则乙容器达到平衡时所需要的时间也是30s | D、在相同的温度和压强下,用甲容器分别进行反应.第一次加入2molA和2molB;第二次加入2molA.2molB和3molC;第三次加入4molC.分别达到化学平衡状态时,C的物质的量百分含量分别为X、Y、Z.则X、Y、Z的大小关系是X=Y=Z |


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 0.1mol/L的Ba(OH)2溶液的体积/mL | 10 | 10 | 10 | 10 | 10 |
| 0.1mol/L的E溶液的体积/mL | 5 | 10 | 15 | 20 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
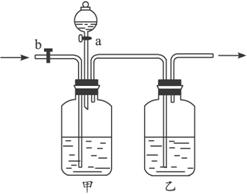
(1)甲瓶中应装入的试剂是__________溶液,乙瓶中应装入的试剂是__________溶液,分液漏斗中应装入的是__________溶液。
(2)当CO与CO2的混合气体通过该装置时,先分离得到的是__________,活塞操作是__________,然后得到的是__________,活塞操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)甲瓶中装的是__________溶液,乙瓶中装的是__________,分液漏斗中装的是__________。
(2)当CO2与CO的混合气体通过该装置时,先分离得到的是__________,活塞操作是__________,然后得到__________,活塞操作是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分) “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
则反应CO(g)+H2(g) +O2(g)=H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
(2)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体在正极反应,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
(3)密闭容器中充有10mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= 。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
A 降温 B 加压 C 使用催化剂 D 将甲醇从混合体系中分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com