
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(A)/(mol•L-1) | 6.00 | 3.50 | 3.00 | 3.00 |
| A. | 500s内A的分解速率为3.0×10-3 mol•L-1•s-1 | |
| B. | 1000s时A的转化率为50%,T1温度下的平衡常数为K1=0.75 | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1>K2,则T1>T2 | |
| D. | 平衡时,其他条件不变,再加入一定量的A,达新平衡后K值增大 |
分析 由表中数据可知达到1000s时A的浓度不再发生改变,则达到平衡状态,结合v=$\frac{△c}{△t}$、k=$\frac{c(B)c(C)}{{c}^{2}(A)}$计算相关物理量,正反应为吸热反应,升高温度,平衡正向移动,以此解答该题.
解答 解:A.500s内A的分解速率为$\frac{6.00mol-3.50mol}{500s}$=5.0×10-3 mol•L-1•s-1,故A错误;
B.1000s时A消耗3mol,则转化率为50%,由 2A(g)?B(g)+C(g)可知达到平衡时,c(A)=3.00mol/L,c(B)=1.5mol/L,c(C)=1.5mol/L,
T1温度下的平衡常数为K1=$\frac{1.5×1.5}{{3}^{2}}$=0.25,故B错误;
C.正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,故C正确;
D.平衡常数只受温度的影响,故D错误.
故选C.
点评 本题涉及化学反应速率计算、化学平衡移动与计算、平衡常数的计算与运用等知识点,为高考常见题型,题目侧重考查学生的分析能力和计算能力,注意掌握平衡常数的意义.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:实验题
| |温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
| 平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮氧化铝中氮的化合价是-3 | |
| B. | 反应中氧化产物和还原产物的物质的量之比是1:2 | |
| C. | 反应中每生成5.7gAlON同时生成1.12LCO | |
| D. | AlON和CO的化学键类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08 | B. | 0.04 | C. | 0.032 | D. | 0.036 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入适量水 | B. | 加入适量NaOH固体 | ||
| C. | 通入适量的O2 | D. | 加入适量的CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
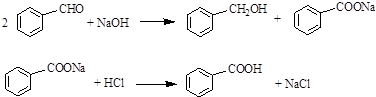
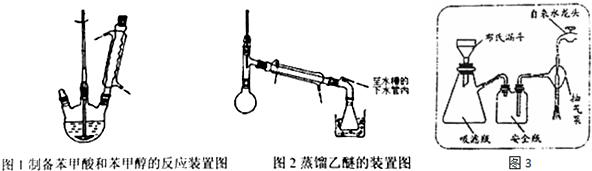
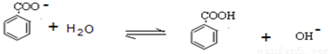 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
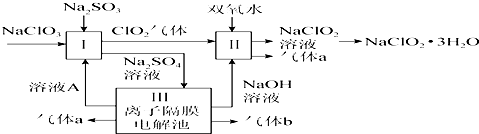
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | H2SO4溶液中投入锌粒:2H++Zn═H2↑+Zn2+ | |
| C. | 用NaHCO3 治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 氯化铁和氢氧化钾溶液混合:Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com