
某学生探究AgCl、Ag2S沉淀转化的原因。
| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是 。
(2)Ⅱ中能说明沉淀变黑的离子方程式是 ,沉淀转化的主要原因是 。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是 。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀______。
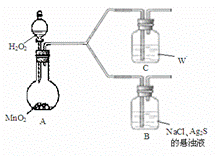
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
| 现 象 | B:一段时间后,出现乳白色沉淀 |
| C:一段时间后,无明显变化 |
①A中产生的气体是_________。
②C中盛放的物质W是_________。
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S + 
 +
+ 
 + 2H2O
+ 2H2O 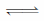 4AgCl +
4AgCl +
 + 4NaOH
+ 4NaOH
④B中NaCl的作用是_______。
【答案】(1)AgCl;(2)2AgCl(s) + S2-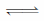 Ag2S(s) + 2Cl-,Ag2S比AgCl溶解度更小
Ag2S(s) + 2Cl-,Ag2S比AgCl溶解度更小
(3)①S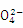 ;②S;(4)①O2;②Ag2S 的悬浊液
;②S;(4)①O2;②Ag2S 的悬浊液
③2Ag2S + 1 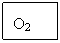
 + 4
+ 4 
 + 2H2O
+ 2H2O  4AgCl + 2
4AgCl + 2 
 + 4NaOH
+ 4NaOH
④O2将Ag2S 氧化生成S时有Ag+游离出来,NaCl中大量的Cl-与游离的Ag+结合成AgCl沉淀。由于c(Ag+)减小,有利于③中反应平衡右移,B中最终出现乳白色沉淀。
【解析】(1)将NaCl与AgNO3溶液混合,二者会发生复分解反应得到白色沉淀氯化银沉淀和硝酸钠溶液,所以白色沉淀是AgCl;(2)向所得固液混合物(氯化银和硝酸钠)中加Na2S溶液,发生反应:2AgCl(s) + S2- Ag2S(s) + 2Cl-,Ag2S比AgCl溶解度更小,所以会出现白色沉淀氯化银转化为黑色沉淀硫化银;
Ag2S(s) + 2Cl-,Ag2S比AgCl溶解度更小,所以会出现白色沉淀氯化银转化为黑色沉淀硫化银;
(3)步骤Ⅲ中乳白色沉淀的推测,其中可能存在被氧化的硫单质,又被硝酸氧化为硫酸根离子,遇到硝酸钡溶液产生白色沉淀硫酸钡,剩余的白色沉淀是氯化银,所以①由ⅰ判断,滤液X中被检出的离子是S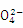 ;②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀S;(4)①双氧水在二氧化锰的催化作用下,产生的气体肯定是氧气,即A中产生的气体是O2;②作为对比试验,B中是含有氯化钠溶液的Ag2S,所以C中是没有氯化钠溶液的Ag2S,即C中盛放的是Ag2S 的悬浊液;③根据质量守恒定律,反应物缺少1molO2和4mol的NaCl,产物缺少2mol的S,即2Ag2S + 1
;②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀S;(4)①双氧水在二氧化锰的催化作用下,产生的气体肯定是氧气,即A中产生的气体是O2;②作为对比试验,B中是含有氯化钠溶液的Ag2S,所以C中是没有氯化钠溶液的Ag2S,即C中盛放的是Ag2S 的悬浊液;③根据质量守恒定律,反应物缺少1molO2和4mol的NaCl,产物缺少2mol的S,即2Ag2S + 1 
 + 4
+ 4 
 + 2H2O
+ 2H2O 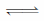 4AgCl + 2
4AgCl + 2 
 + 4NaOH;④在该实验中,O2将Ag2S 氧化生成S,有Ag+游离出来,NaCl中大量的Cl-与游离的Ag+结合成AgCl沉淀。由于c(Ag+)减小,有利于③中反应平衡右移,B中最终出现乳白色沉淀。
+ 4NaOH;④在该实验中,O2将Ag2S 氧化生成S,有Ag+游离出来,NaCl中大量的Cl-与游离的Ag+结合成AgCl沉淀。由于c(Ag+)减小,有利于③中反应平衡右移,B中最终出现乳白色沉淀。


科目:高中化学 来源: 题型:
有Xn+、Ym+、Zn﹣,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数.若按X→Y→Z的顺序,下列说法中正确的是( )
A. 它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强
B. 它们的原子半径依次增大
C. 它们的单质在常温.常压下的密度依次减小
D. 它们的最高价氧化物的水化物都是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
用含有少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极减少的Cu的质量为m g,则()
A. 电解液质量增加m g B. 阴极质量增加a g,a>m
C. 阴极质量增加m g D. 阴极质量增加b g,b<m
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录。
| 步 骤 | 现 象 |
| I. 取5 mL 0.1 mol/L AgNO3与一定体积0.1 mol/L NaCl溶液,混合,振荡。 | 立即产生白色沉淀 |
| II. 向所得悬浊液中加入2.5 mL 0.1 mol/L Na2S溶液。 | 沉淀迅速变为黑色 |
| III. 将上述黑色浊液,放置在空气中,不断搅拌。 | 较长时间后,沉淀变为乳白色 |
| IV. 滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液。 | 产生红棕色气体,沉淀部分溶解 |
| V. 过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液。 | 产生白色沉淀 |
(1) 为了证明沉淀变黑是AgCl转化为Ag2S的缘故,步骤I中NaCl溶液的体积范围为 。
(2) 已知:25℃时Ksp(AgCl)=1.8×10-10 ,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K= 。
(3)步骤V中产生的白色沉淀的化学式为 ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 。
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
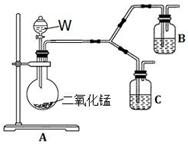
①装置A中玻璃仪器有圆底烧瓶、导管和 ,试剂W为 。
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为 。
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:
□Ag2S + □NaCl + □ + □  □AgCl + □ S + □
□AgCl + □ S + □
B中NaCl的作用是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了得到比较纯净的物质,使用的方法恰当的是
A.向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体
B.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com