
定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:
(1)在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g•℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式(写出最后结果)△H=__________KJ/mol。
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6 kJ的热量。请写出表示该反应中和热的热化学方程式 。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为: (用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 (填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为 。
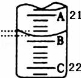
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为 mL。
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C= mol/L。
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源:2016-2017学年福建省三明市高一上期中化学试卷(解析版) 题型:填空题
世界环保联盟即将全面禁止在自来水中加氯气(Cl2,黄绿色气体),推广采用光谱高效消毒剂二氧化氯,目前欧州和 我国主采用Kesting法[原料为氯酸钠(NaClO3)与盐酸]制取ClO2,该法的缺点是同
我国主采用Kesting法[原料为氯酸钠(NaClO3)与盐酸]制取ClO2,该法的缺点是同 时会产生Cl2.该法制ClO2的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
时会产生Cl2.该法制ClO2的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(1)该反应中,氧化剂为____________,氧化产物为____________.
(2)若反应生成0.1mol Cl2,则转移的电子的物质的量为____________.
(3)盐酸在反应中显示出来的性质是:(填写编号)____________.
①还原性 ②还原性、酸性 ③氧化性 ④氧化性、酸性.
(4)由化学方程式可以推出:还原性大小比较:HCl>____________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上学期期中化学试卷(解析版) 题型:选择题
下列对阿伏伽德罗定律及推论的理解不正确的是( )
A.同温同压下,气体的体积之比等于它们的物质的量之比
B.同温同压下,气体的体积之比等于它们的质量之比
C.同温同压下,相同体积的气体质量比等于它们的相对分子质量之比
D.同温同压下,气体的密度之比等于它们的相对分子质量之比
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上月考四化学试卷(解析版) 题型:推断题
【化学----选修有机化学基础】1,4- 二苯基丁烷是用来研究聚合物溶剂体系热力学性质的重要物质,工业上用下列方法制备1,4-二苯基丁烷:
友情提示:格拉泽反应:2R—C≡C—H 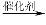 R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
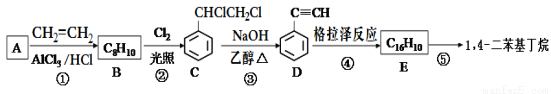
回答下列问题:
(1)D的官能团的名称为 。
(2)①和③的反应类型分别为 、 。
(3)E的结构简式为 。用1 mol E合成1,4-二苯基丁烷,理论上需要消耗氢气___________mol。
(4)请写出反应①的化学方程式____________________。
(5)化合物C在氢氧化钠的水溶液中加热可得到化合物F,请写出化合物F和乙酸反应的化学方程式___________________________。
(6)芳香化合物G是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为1:1,写出其结构简式为_______________________________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上月考四化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.将NO2气体通入NaOH溶液中:3NO2+2OH-=2NO3-+NO↑+H2O
B.将铁丝插入过量的稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.IBr和Cl2的化学性质相似,将IBr通入NaOH溶液中:IBr+2OH-=I-+BrO-+H2O
D.Na2S溶液通入足量SO2气体:2S2-+SO2+2H2O=3S↓+4OH-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
α1和α2,c1和c2分别为两个恒容容器中平衡体系N2O4(g) 2NO2(g)和3O2(g)
2NO2(g)和3O2(g) 2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
A.α1、α2均减小,c1、c2均增大
B.α1、α2均增大,c1、c2均减小
C.α1减小,α2增大,c1、c2均增大
D.α1减小,α2增大,c1增大,c2减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
某温度下,在密闭容器中进行SO2的催化氧化反应。若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L ,则下列叙述中正确的是
,则下列叙述中正确的是
A.SO2的转化率为60%
B.SO3的产率为60%
C.平衡时总压强与起始压强之比为7∶8
D.平衡时V(SO2):V(O2):V(SO3)=3∶3∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五县七校高一上期中化学试卷(解析版) 题型:计算题
硫酸和盐酸组成的混合液100.0 mL,向其中加入氢氧化钡粉末4.275g,充分反应后,经过滤、洗涤、干燥,得到沉淀2.330g,同时测得滤液中的OH-离子浓度为0.100 mol·L-1 。(设溶液总体积始终不变)请列式计算
mL,向其中加入氢氧化钡粉末4.275g,充分反应后,经过滤、洗涤、干燥,得到沉淀2.330g,同时测得滤液中的OH-离子浓度为0.100 mol·L-1 。(设溶液总体积始终不变)请列式计算
(1)原溶液中硫酸的物质的量为____________。
(2)原混合液中盐酸的物质的量浓度_______________。
(3)若将原硫酸和盐酸混合溶液100ml与足量金属锌反应,则在标况下产生的气体体积为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五县七校高二上期中化学试卷(解析版) 题型:选择题
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态。下列说法正确的是
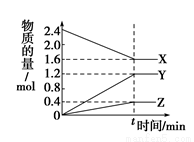
A.该反应的化学方程式为: 2X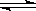 3Y + Z
3Y + Z
B.10s时Y的平均速率为0.12 mol·L-1·min-1
C.X的转化率为66.7%
D.增大压强,该反应速率一定加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com