
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
【答案】(10分)(1)Cu+2 H2SO4(浓)![]() CuSO4+ SO2↑+ 2H2O;
CuSO4+ SO2↑+ 2H2O;
(2)白色无水硫酸铜可与水结合生成蓝色的CuSO4·5 H2O,显示水合铜离子特征蓝色;
(3)正四面体,sp3;(4)6s1; 3:1;金属键;(5)H8AuCu3
【解析】(1)Cu+2 H2SO4(浓)![]() CuSO4+ SO2↑+ 2H2O;
CuSO4+ SO2↑+ 2H2O;
(2)白色无水硫酸铜可与水结合生成蓝色的CuSO4·5 H2O,显示水合铜离子特征蓝色;
(3)正四面体,sp3;(4)类比铜原子最外层得:6s1;在晶胞中Cu原子处于面心,6×1/2=3,Au原子处于顶点位置,8×1/8=1,则该合金中Cu原子与Au原子数量之比为3:1;金属键;(5)类比CaF2的晶胞图,Ca2+占据顶点和面心,晶胞内填充4个F-,类比一下,Cu占据面心,Au占据顶点,那H2只能占据晶胞内部的空间了,一个H2分子相当于一个F-,这样看来一个晶胞分摊一个Au原子,3个Cu原子,4个H2分子,所以化学式为AuCu3(H2)4,就是答案上的H8AuCu3。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酰氰酯(结构简式为 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为________________。组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为____________________。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是____________、___________, 1个氯磺酰氰酯分子中含有σ键的数目为______________,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为_________________。
(3)ClO4-的空间构型为__________________。
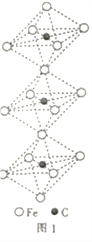
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为________________。
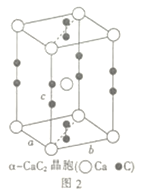
(5)电石(CaC2)是制备氯化氰(ClCN)的重要原料。四方相碳化钙(CaC2)的晶胞结构如上图2所示,其晶胞参数分别为a、b、c,且a=b,c=640pm。已知四方相碳化钙的密度为1.85g·cm-3,[C≡C]2-中键长为120pm,则成键的碳原子与钙原子的距离为________pm和_______pm。(设阿伏加德罗常数的数值为6×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
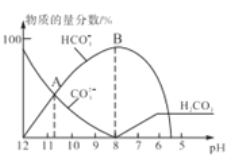
A. 常温下,水解常数Kh(CO32-)的数量级为10-4
B. 当溶液是中性时,溶液的总体积大于20mL
C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D. 在B点所示的溶液中,离子浓度最大的是HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NaCl、NaOH、AgNO3三种溶液,只用一种试剂就可把它们鉴别开来,该试剂是( )
A.FeCl3溶液
B.Na2CO3溶液
C.MgCl2溶液
D.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体。潮湿环境中易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂,可溶于水)。其制备装置及步骤如下:

①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色品体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到5.64g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为__________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)步骤④中进行洗涤的操作方法为________________________________。
(6)洗涤产品时,如何证明产品已经洗涤干净?______________________。
(7)本实验中[Cr(CH3COO)2]2·2H2O (相对分子质量为376)的产率是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到目的的是( )
A. 用品红溶液检验SO2
B. 用焰色反应鉴别KNO3和KCl
C. 用澄清石灰水鉴别MgCl2溶液和NaHCO3溶液
D. 用丁达尔效应区分FeCl3溶液和Fe2(SO4)3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、Z的分子式均为C7H8,结构简式如图。下列说法正确的是
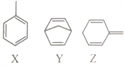
A. X、Y、Z分子中碳原子均能处在同一平面上
B. X、Y、Z三种有机物均能使酸性高锰酸钾溶液褪色
C. 1molX与Z的混合物中含有3mol碳碳双键
D. Y的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
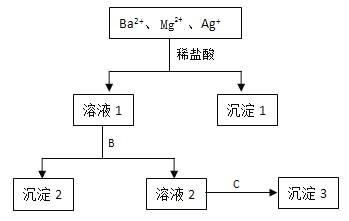
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com