
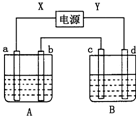
 如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.
如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.分析 通电一段时间后,发现d电极上覆盖一层红色物质,则d电极是电解池阴极,a、c电极是阳极,b是阴极,X是正极,Y是负极.
(1)c电极上失电子发生氧化反应;
(2)A槽中,阳极上氯离子失电子发生氧化反应,阴极上氢离子得电子发生还原反应;
(3)根据A槽中酸浓度的变化判断pH的变化.
解答 解:通电一段时间后,发现d电极上覆盖一层红色物质,则d电极是电解池阴极,a、c电极是阳极,b是阴极,X是正极,Y是负极.
(1)c电极是电解池阳极,阳极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,
故答案为:Cu-2e-=Cu2+;
(2)A槽中,阳极上氯离子失电子发生氧化反应生成氯气,阴极上氢离子得电子发生还原反应生成氢气,电解方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)A槽发生2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,生成NaOH,则溶液pH增大,故答案为:变大.
点评 本题考查了电解原理,难度不大,注意电解含氧强酸和强碱实际上就是电解水,会导致溶液的物质的量浓度增大,从而引起溶液pH的变化.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极 | |
| C. | 负极反应为:2H++2e-═H2↑ | |
| D. | 该装置能将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 原子半径:B>A>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 在化学反应前后催化剂性质和质量都不改变 | |
| C. | 催化剂能改变化学反应速率 | |
| D. | 在化学反应过程中,催化剂能提高转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向10ml 0.1mol•L-1NH4HSO4溶液中滴加10ml 0.1mol•L-1NaOH溶液:2c(SO42-)═c(NH4+)+c(NH3•H2O) | |
| B. | 等体积等浓度NaHCO3溶液和Na2CO3溶液混合:$\frac{C(HC{O}_{3}^{-})}{C({H}_{2}C{O}_{3})}$<$\frac{C(C{O}_{3}^{2-})}{C(HC{O}_{3}^{-})}$ | |
| C. | 物质的量浓度均为0.1mol•L-1Na2S溶液、NaHS溶液等体积混合所得溶液中:2c(OH--)-2c(H+)═3 c(H2S)+c(HS--)-c(S2--) | |
| D. | 将足量的AgCl分别放入:①5 ml水 ②10 ml 0.2mol•L-1MgCl2溶液③20ml0.3mol•L-1盐酸中溶解至饱和,c(Ag+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水中:Ba2+、Fe2+、CO32- | |
| B. | 0.1 mol•L-1HNO3溶液中:Mg2+、SO42-、Cl- | |
| C. | 0.1 mol•L-1NH4Cl溶液中:K+、OH-、SO42- | |
| D. | 使石蕊变红色的溶液中:Na+、Cu2+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
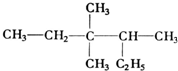 的正确命名为( )
的正确命名为( )| A. | 2-乙基-3,3-二甲基-4-乙基戊烷 | B. | 3,3,4-三甲基已烷 | ||
| C. | 3,3-二甲基-4-乙基戊烷 | D. | 2,3,3-三甲基已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
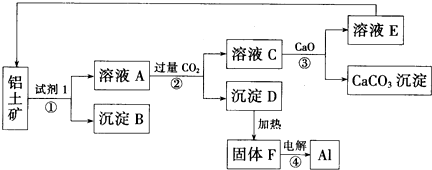
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com