
【题目】相同条件下,等物质的量的两种气体一定满足
A.体积均为22.4 L B.具有相同的体积
C.是双原子组成的分子 D.所含原子数目相同
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】古代炼丹的五金通常是指金、银、铜、铁、锡。下列说法错误的是
A.用焦炭热还原SnO2可得到SnB.用H2还原Fe2O3可得到Fe
C.Cu2S与过量O2共热产物中只含CuD.Ag2O直接热分解可得到Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后(体积损失不计),溶液中SO42﹣的物质的量浓度约为( )
A.0.35mol/L
B.0.45mol/L
C.0.5mol/L
D.0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.46mol SO2和0.22mol氧气放入容积为2L的密闭容器中,发生反应2SO2 (g)+O2 (g)2SO3 (g),在一定温度下,反应达到平衡,得到0.24mol SO3 , 则反应的平衡常数K= . 若温度不变,再加入1.0mol氧气后重新达到平衡,则SO2的平衡浓度(填“增大”、“不变”或“减小”),氧气的转化率(填“升高”、“不变”或“降低”),SO3的体积分数(填“增大”、“不变”或“减小”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2的摩尔质量是2 g B.1 mol H2O的质量是18 g/mol
C.氧气的摩尔质量是32 g/mol D.2 g H2含1 mol H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质不是萃取剂所具有的是( )
A. 与原溶剂互不相溶 B. 一定为无机物
C. 与原溶剂不反应 D. 溶质在萃取剂里的溶解度要比在原溶剂中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( ) 
A.离子半径大小:Y>Z>W
B.简单气态氢化物的稳定性:R>Y
C.W的最高价氧化物对应的水化物碱性比Z的强
D.单质熔点:Z>R>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是( )
A.制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+
B.H2SO4溶液中投入锌粒:2H++Zn═H2↑+Zn2+
C.用NaHCO3 治疗胃酸过多:HCO3﹣+H+═CO2↑+H2O
D.氯化铁和氢氧化钾溶液混合:Fe3++3OH﹣═Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组通过下列反应原理制备SO2并进行性质探究.反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O 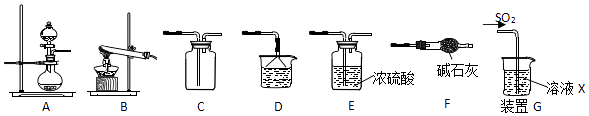
(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为 .
(2)D中盛装的试剂为 .
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的 , 可观察到的现象 .
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4 , 为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3﹣能将H2SO3氧化为SO42﹣ |
(5)丙同学认为以上实验只能说明Fe3+和酸性条件下NO3﹣均能将H2SO3氧化为SO42﹣ , 不能说明谁先氧化H2SO3 , 他利用提供的试剂(限选试剂:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)设计实验方案探究何种微粒先发生反应.请帮助他完成方案(包括操作现象和结论):取乙同学实验1后装置G中烧杯的上层清液于试管中, .
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com