
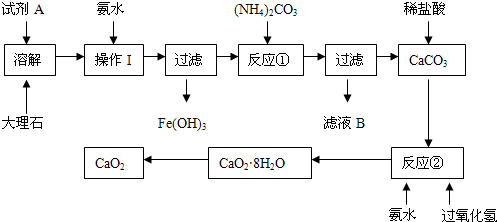


科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.取少量样品放入试管中,加热,试管口放一团蘸有无水硫酸铜粉末的棉花团,变蓝则可证明晶体的成分中含有结晶水 |
| B.取少量样品溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.取少量样品溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取少量样品放入试管中,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中是否含有NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可用25ml酸式滴定管量取20.00ml KMnO4溶液 |
| B.从碘水中提取单质碘,不能用无水乙醇代替CCl4 |
| C.石蕊试纸和PH试纸使用前用蒸馏水润湿 |
| D.CO2中混有少量SO2,除杂试剂和方法为:KMnO4(H+)、浓硫酸,洗气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 物质成分(括号内为杂质) | 所用试剂 | 操作 |
| A | 铁屑(油污) | 纯碱溶液 | 洗涤 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 碳酸钡(硫酸钡) | 盐酸 | 溶解、过滤 |
| D | 乙醇(乙酸) | 烧碱溶液 | 分液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
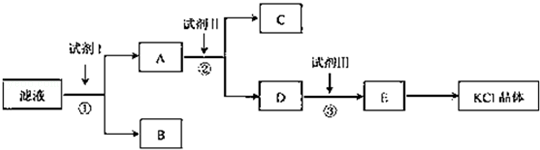
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟产生 | X一定是浓盐酸 |
| B | 某钠盐W中加入稀硫酸,产生的无色无味的气体通入澄清石灰水 | 石灰水变浑浊 | W一定是Na2CO3 |
| C | 强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀, 后溶液又变红 | Y中一定含有SO42-和Fe3+ |
| D | 少量气态炔烃Z通入pH=a的溴水中 | 溴水褪色,溶液的pH仍约为a | Z与溴发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某钠盐中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 说明该盐一定是碳酸盐 |
| B | 向某无色溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀又会全部消失 | 该无色溶液中一定有Al3+,无Mg2+ |
| C | 向尿液中加入新制Cu(OH)2,没有砖红色沉淀生成 | 说明尿液中不含有葡萄糖 |
| D | 某待测液中先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色 | 该待测液中一定含有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com