
【题目】下列情况能作为可逆反应达到化学平衡状态的标志是( )
①反应N2 + 3H2![]() 2NH3 在等温等容条件下进行时气体压强保持不变。
2NH3 在等温等容条件下进行时气体压强保持不变。
②反应2BaO2(s)![]() 2BaO(s)+O2(g)在一定温度下进行时,气体的平均相对分子质量保持不变
2BaO(s)+O2(g)在一定温度下进行时,气体的平均相对分子质量保持不变
③N2 + 3H2![]() 2NH3在一定条件下进行,断裂0.6molH─H键的同时断裂1.2molN─H键
2NH3在一定条件下进行,断裂0.6molH─H键的同时断裂1.2molN─H键
④反应2SO2(g)+O2(g) ![]() 2SO3(g)进行一段时间后2v正(SO3)=v逆(O2)
2SO3(g)进行一段时间后2v正(SO3)=v逆(O2)
⑤反应2HI(g)![]() H2(g)+ I2(g)在一定温度和压强下进行时,气体的密度保持不变。
H2(g)+ I2(g)在一定温度和压强下进行时,气体的密度保持不变。
A. ①③ B. ①③⑤ C. ①②③ D. ②④
【答案】A
【解析】①N2 + 3H2![]() 2NH3为反应前后气体体积不等的可逆反应,在等温等容条件下进行时气体压强保持不变,说明反应达到了平衡状态,故①符合;②反应2BaO2(s)
2NH3为反应前后气体体积不等的可逆反应,在等温等容条件下进行时气体压强保持不变,说明反应达到了平衡状态,故①符合;②反应2BaO2(s)![]() 2BaO(s)+O2(g)中只有氧气是气体,则气体的平均相对分子质量始终不变,所以在一定温度下进行时,气体的平均相对分子质量保持不变,不能说明反应达到了平衡状态,故②不符合;③N2 + 3H2
2BaO(s)+O2(g)中只有氧气是气体,则气体的平均相对分子质量始终不变,所以在一定温度下进行时,气体的平均相对分子质量保持不变,不能说明反应达到了平衡状态,故②不符合;③N2 + 3H2![]() 2NH3在一定条件下进行,断裂0.6molH─H键的同时断裂1.2molN─H键,说明正反应速率等于逆反应速率,反应达到了平衡状态,故③符合;④反应2SO2(g)+O2(g)
2NH3在一定条件下进行,断裂0.6molH─H键的同时断裂1.2molN─H键,说明正反应速率等于逆反应速率,反应达到了平衡状态,故③符合;④反应2SO2(g)+O2(g) ![]() 2SO3(g)进行一段时间后,2v正(SO3)=v逆(O2),正反应速率不等于逆反应速率,说明不是平衡状态,故④不符合;⑤反应2HI(g)
2SO3(g)进行一段时间后,2v正(SO3)=v逆(O2),正反应速率不等于逆反应速率,说明不是平衡状态,故④不符合;⑤反应2HI(g)![]() H2(g)+ I2(g)为反应前后气体体积相等的可逆反应,且三种物质均为气体,气体的密度始终不变,则在一定温度和压强下进行时,气体的密度保持不变不能说明反应达到了平衡状态,故⑤不符合;综上所述,答案选A。
H2(g)+ I2(g)为反应前后气体体积相等的可逆反应,且三种物质均为气体,气体的密度始终不变,则在一定温度和压强下进行时,气体的密度保持不变不能说明反应达到了平衡状态,故⑤不符合;综上所述,答案选A。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 标准状况下,2.24 L H2O所含的原子数为0.5NA
B. 1 mL 1 mol/L NaCl溶液中离子总数为2NA
C. 18 g的H2O中含有的电子数为3NA
D. 标准状况下,22.4 L氩气所含质子数为18NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.19g/mL、质量分数为36.5%的浓盐酸配制230ml,1mol/L的盐酸。请回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为________,配制230ml,1mol/L的盐酸。
应量取浓盐酸的体积/mL | 实验需要的玻璃仪器(除烧杯、量筒) |
________ | ________ |
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是____。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)_____。
A.用30mL蒸馏水洗涤烧杯2-3次,洗涤液均注入容量瓶中,振荡
B.用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量蒸馏水(35mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入所选容积的容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管滴加蒸馏水,使 __________________________________
F.往容量瓶内加蒸馏水,直到溶液在刻度线下1~2cm处
(4)若出现以下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
定容时俯视刻度线______________,定容后,盖上玻璃塞倒转摇匀,发现液面低于刻度线,继续滴加蒸馏水至刻度线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X位于Y的下一周期,X、Y的原子序数均不大于20。某含氧酸盐甲的化学式为XYO3。请回答:
(1)常温下Y的单质能与水发生反应,则X位于周期表_________,X、Y形成简单离子半径大小关系为X_____________Y(填“大于”、“小于”或“等于”)。395℃时,甲能发生分解反应生成两种盐,一种是含Y元素的无氧酸盐,该反应的化学方程式是_____________。
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体。
①则甲为___________(填化学式)。该气体能使高锰酸钾溶液褪色,该反应的离子方程式为_______________。
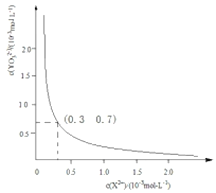
②25℃时,甲在水中的沉淀溶解平衡曲线如下图所示,若要使溶液X2+离子沉淀完全,则加入![]() 离子的最小浓度为___________molL﹣1。
离子的最小浓度为___________molL﹣1。
(3)若甲能与盐酸反应,生成无色、无味的气体乙。则:
①乙中所含化学键类型____________。
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答问题:
(1)写出E的基态原子的电子排布式___________。
(2)含有元素D的盐的焰色反应为____色,许多金属形成的盐都可以发生焰色反应,其原因是__________________________________________。
(3)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为____________________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。
(4)G与C可形成化合物GC和G2C,已知GC在加热条件下易转化为G2C,试从原子结构的角度解释发生转化的原因________________________。
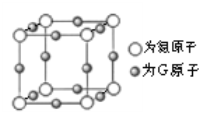
(5)G与氮元素形成的某种化合物的晶胞结构如下图所示,则该化合物的化学式为__________,氮原子的配位数为__________。若晶体密度为a g·cm-3,则G原子与氮原子最近的距离为__________pm(写出数学表达式,阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子(多聚体),X、Y、Z、P分别为构成生物大分子的基本单位(单体)。请回答下列问题:
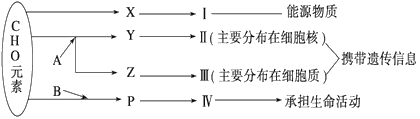
(1)图中X被形容为“生命的燃料”,它是_____,Ⅰ在小麦种子中主要是指________。
(2)A和B各表示_______元素和________元素。
(3)P的结构通式是___________________,组成蛋白质的P的种类约有__________种。
(4)Y和Z在化学组成上的区别是:Z特有的成分是___________(五碳糖)和___________。在观察Z和Y在细胞中的分布时,要用到质量分数为8%的HCl作用为:①________________________________________②__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法。下列关于“Na2CO3”的分类错误的是
A.Na2CO3俗名为纯碱,故它属于碱类B.Na2CO3属于化合物
C.Na2CO3属于强电解质D.Na2CO3属于含氧酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)一个X原子的质量_________g。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol·L-1。
(5)该气体溶于1L水中(不考虑反应),所得溶液的密度为ρg/cm3,则该溶液的物质的量浓度为__________mol·L-1。
(6)相同状况下,若X2与氮气以体积比1:4混合,该混合气体相对氢气密度为14.4,X2的相对分子质量为_______。
(7)若标况下X2的密度为1.25 g/L,X原子最外层有_____个电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com