
分析 无色溶液中不可能含有Cu2+,(1)少量溶液于试管中,加入过量Ba(OH)2溶液,无沉淀生成,一定没有SO42-、CO32-,经加热逸出的气体能够使润湿的红色石蕊试纸变蓝,气体是氨气,则说明原溶液中一定存在铵根离子;
(2)另取少量原溶液于试管中,加入稀硝酸和硝酸银混合溶液,有白色沉淀生成,即氯化银沉淀,据此回答判断即可;
(3)根据实验过程确定离子的存在情况.
解答 解:无色溶液中不可能含有Cu2+,(1)少量溶液于试管中,加入过量Ba(OH)2溶液,无沉淀生成,一定没有SO42-、CO32-,经加热逸出的气体能够使润湿的红色石蕊试纸变蓝,气体是氨气,发生了反应:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,则说明原溶液中一定存在铵根离子;故答案为:NH4+;Cu2+、SO42-、CO32-;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(2)另取少量原溶液于试管中,加入稀硝酸和硝酸银混合溶液,有白色沉淀生成,即氯化银沉淀,则含有氯离子,发生反应:Cl-+Ag+=AgCl↓.
故答案为:Cl-;Cl-+Ag+=AgCl↓;
(3)通过上述实验,还无法确定的离子有Na+、NO3-,故答案为:Na+、NO3-.
点评 本题考查了离子检验的实验方法和反应现象分析判断,熟练掌握离子共存的条件及离子性质是解题关键,题目难度中等.


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2 (g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2 (g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2 (g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | 2CO2 (g)+2NaOH(aq)═2NaHCO3(aq)△H=-(8x-y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 2:3 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol/L | B. | 1.5mol/L | C. | 3mol/L | D. | 7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
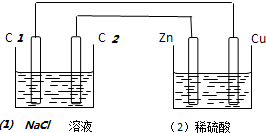
| A. | (1)中C2电极反应式为:2Cl--2e-═Cl2 | B. | (2)溶液中的SO42-向Cu极定向移动 | ||
| C. | (1)中滴入酚酞试液,C1极附近先变红 | D. | (2)中溶液的PH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与二氧化碳反应 | B. | 铁和稀硫酸的反应 | ||
| C. | 氢氧化钡晶体的粉末和稀硫酸混合 | D. | 木炭在氧气中燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com