

分析 (1)实验室制取氧气常用方法有:①2KClO3$\frac{\underline{催化剂}}{△}$KCl+3O2↑、②2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑、③2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑、④2Na2O2+2H2O=4NaOH+O2↑,①和②的装置采用固体+固体$\stackrel{△}{→}$气体的典型装置,③和④的装置采用固体+液体→气体的典型装置.
(2)化学反应中元素化合价降低的物质做氧化剂;
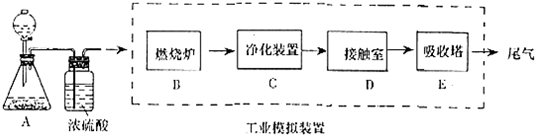
(3)从沸腾炉中出来的成分为SO2、O2、N2、水蒸气、灰尘、砷硒化合物等;
(4)如果D装置的温度是400℃~500℃,在常压下生成0.1molSO3,可放出9.83kJ的热量,则生成2molSO3放热196.6KJ,标注物质聚集状态和对应反应的焓变写出热化学方程式,二氧化硫催化氧化为三氧化硫的反应在常压下转化率很高,增大压强二氧化硫的转化率增大不大;
(5)从接触室出来的气体成分SO2、O2、N2、SO3,从实验装置分析,主要是为了检验SO2、SO3气体,SO3气体可溶解与浓硫酸中,所以装置B采用98.3%的浓硫酸目的是除去SO3气体的,则SO3气体的检验只能在装置A中进行,SO2气体的检验吸收则在装置C中进行,选用高锰酸钾溶液或溴水溶液.
解答 解(1)实验室制取氧气常用方法有:①2KClO3$\frac{\underline{催化剂}}{△}$KCl+3O2↑、②2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑、③2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑、④2Na2O2+2H2O=4NaOH+O2↑,①和②的装置采用固体+固体$\stackrel{加热}{→}$气体的典型装置,③和④的装置采用固体+液体→气体的典型装置,装置A中锥形瓶盛放固体、分液漏斗盛放液体,所以装置A符合固体+液体→气体的典型装置,
可以采用2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑、2Na2O2+2H2O=4NaOH+O2↑反应原理制取氧气.
故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑;
(2)沸腾炉中黄铁矿与氧气的反应为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 ,元素化合价降低的做氧化剂,氧元素化合价0价变化为-2价,氧气做氧化剂,铁元素和硫元素化合价升高做还原剂,硫元素化合价-1价变化为+4价,铁元素化合价+2价变化为+3价,反应4molFeS2电子转移44mol,若消耗了12gFeS2物质的量=$\frac{12g}{120g/mol}$=0.1mol,则电子转移1.1mol,
故答案为:O2;1.1;
(3)从沸腾炉中出来的成分为SO2、O2、N2、水蒸气、灰尘、砷硒化合物等,C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是,砷硒化合物能导致催化剂失去催化活性,所以在进入接触室前要除去水蒸气、灰尘、砷硒化合物,
故答案为:催化剂中毒;
(4)如果D装置的温度是400℃~500℃,在常压下生成0.1molSO3,可放出9.83kJ的热量,则生成2molSO3放热196.6KJ,标注物质聚集状态和对应反应的焓变写出热化学方程式,反应常压下二氧化硫转化率已经很大,增大压强二氧化硫转化率增大不多,且对设备要求高,所以工业中不采取加压措施,
故答案为:2SO3(g)+O2(g)=2SO2(g)△H=-196.6KJ/mol;反应常压下二氧化硫转化率已经很大,增大压强二氧化硫转化率增大不多,且对设备要求高;
(5)从接触室出来的气体成分SO2、O2、N2、SO3,从实验装置分析,主要是为了检验SO2、SO3气体,SO3气体可溶解与浓硫酸中,所以装置B采用98.3%的浓硫酸目的是除去SO3气体的,则SO3气体的检验只能在装置A中进行,SO2气体的检验则在装置C中进行.
①SO3气体的检验利用BaCl2溶液,BaCl2溶液可与SO3气体反应:BaCl2+SO3+H2O═BaSO4↓+2HCl,而BaCl2溶液不与SO2气体反应,所以观察到装置A中出现白色沉淀,则可确定气体中含有SO3气体,
故答案为:BaCl2溶液;
②装置B采用98.3%的浓硫酸目的是除去SO3气体,如果采用饱和NaHSO3溶液代替98.3%的浓硫酸,则饱和NaHSO3溶液既可吸收SO3气体,反应方程式为:2NaHSO3+SO3═Na2SO4+2SO2↑+H2O,该反应生成SO2气体,会影响后面装置C中SO2气体的检验,
故答案为:除去SO3气体;不可行;SO3与NaHSO3反应生成SO2,对实验结果造成干扰;
③SO2气体的检验利用品红溶液或溴水或酸性KMnO4溶液等,SO2气体可使品红溶液的红色褪色,再加热又恢复红色;SO2气体可使溴水的橙色褪色,反应为:SO2+Br2+2H2O═H2SO4+2HBr,SO2气体可使酸性KMnO4溶液紫色褪色,反应为:2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4;
故答案为:酸性KMnO4溶液或溴水;检验并吸收SO2.
点评 本题主要考查计算能力、分析能力、实验设计能力,要求较高,需要扎实的基础知识作依托,尤其是检验从接触室出来的气体成分需要有对知识的综合运用和迁移能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X的反应速率为0.2 mol/(L•s),则Z的反应速率为0.3 mol/(L•s) | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小容器体积,NO2体积分数减小,混合气体颜色变浅 | |
| B. | 保持容器体积不变,加入少许NO2,重新达到平衡时,NO2的体积分数增大 | |
| C. | 保持容器体积不变,加入少许N2O4再达到平衡时,气体颜色变深 | |
| D. | 保持容器体积不变,加入少许NO2,将使正反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化学是研究有机物的组成、结构、性质、制备方法与应用的科学 | |
| B. | CO、H2CO3等含碳元素的化合物视作无机物的理由是他们的组成和性质跟无机物相似 | |
| C. | 迄今为止,人类发现和合成的有机物已超过3000万种 | |
| D. | 有机物受热不易分解,且不易燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的密度不随时间变化而变化 | |
| B. | 3v正(B)=v逆(D) | |
| C. | D的物质的量分数在混合气体中保持不变 | |
| D. | B、C、D的分子个数之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
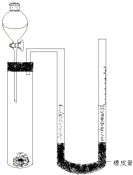 在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com