
| A. | 水 | B. | NaNO3溶液 | C. | NaCl溶液 | D. | CuSO4粉末 |
分析 根据发生的反应为Fe+2H+═Fe2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,以此来解答.
解答 解:根据发生的反应为Fe+2H+═Fe2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,
A、加入水,氢离子的浓度减小,但氢离子的物质的量没有变化,则反应速率减慢,不影响产生氢气的总量,故A错误;
B、加入NaNO3溶液,Fe与硝酸根离子、氢离子发生氧化还原反应生成NO,而不生成氢气,故B错误;
C、加入NaCl溶液,体积增加,氢离子浓度减小,会减慢反应速率,但不影响产生氢气的总量,故C错误;
D、加入CuSO4,构成Fe、Cu、盐酸原电池,但氢离子的物质的量没有变化,则反应速率加快,不影响产生氢气的总量,故D正确;
故选D.
点评 本题以化学反应来考查影响反应速率的因素,明确氢离子浓度减小是减慢反应速率的关系,A选项为学生解答中的易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
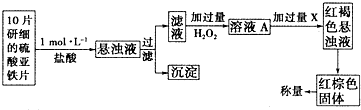
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使品红、酸性高锰酸钾溶液褪色,分别体现了它的漂白性和还原性 | |
| B. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已经变质 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加盐酸沉淀不溶解,说明该溶液一定存在SO42- | |
| D. | 浓硫酸可用于干燥H2、NO2等气体,但不能干燥NH3、SO2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-被还原 | |
| B. | 消耗1mol还原剂,转移3mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
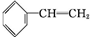 +Br2→
+Br2→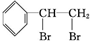 ,反应类型是加成反应.
,反应类型是加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
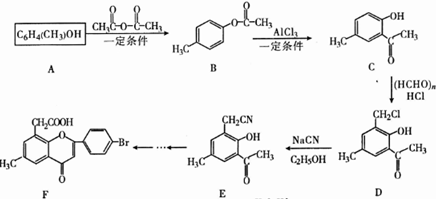
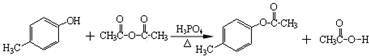
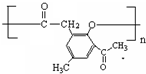 .
.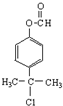 、
、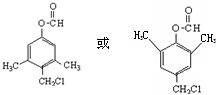 .
.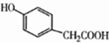 )的路线
)的路线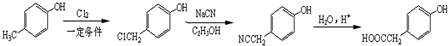 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 拆开2molH2(g)和1 molO2 (g)中的化学键成为H、O原子,共放出1368 kJ能量 | |
| B. | 由H、O原子形成2 molH2O(g),共吸收1852 kJ能量 | |
| C. | 2 molH2(g)和1 molO2(g)反应生成2 molH2O(1),共吸收484 kJ能量 | |
| D. | 2 molH2(g)和1 molO2 (g)反应生成2 moIH2O(g),共放出484 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
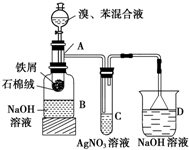 某同学为证明溴与苯发生的是取代反应而非加成反应设计了如下所示的实验装置图,其中A为一支试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再放入少量铁屑.
某同学为证明溴与苯发生的是取代反应而非加成反应设计了如下所示的实验装置图,其中A为一支试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再放入少量铁屑. (有机物要写结构简式).
(有机物要写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com