
(18分)现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2
⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述物质中属于电解质有: (用物质序号填空),
可以利用⑦具有 现象这一简单物理方法区分⑦、⑧二种分散系。
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH- H2O,该离子反应对应的化学方程式为
。
H2O,该离子反应对应的化学方程式为
。
少量的④通入⑥的溶液中反应的离子方程式为 。
(3)17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为 ,
SO42-的物质的量浓度为 。
(4)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,
写出该反应的离子方程式并标出电子转移方向和数目:
当有4.48升(标况)NO气体产生时,转移电子的物质的量为 ,被还原HNO3 的质量为 克。
(18分)(1) ③⑤⑥⑩ 丁达尔
(2)
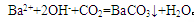
(3)
(4) , 0.6mol,
12.6 克
, 0.6mol,
12.6 克
【解析】
试题分析:(1)溶于水或在熔融状态下能够导电的化合物是电解质,所以答案选③⑤⑥⑩。⑦是胶体,⑧是溶液,所以可以通过丁达尔效应区分二者。
(2)根据离子方程式H++OH-=H2O可知,该反应应该是强酸和强碱之间发生的中和反应,所以符合条件的是硝酸和氢氧化钡,由于硫酸和氢氧化钡反应还有白色沉淀硫酸钡生成,所以不符合。
(3)17.1g硫酸铝的物质的量是17.1g÷342g/mol=0.05mol,含有0.15molSO42-,所以数目是0.15mol×1×1023/mol=9.03×1022。SO42-的物质的量浓度为0.15mol÷0.25L=0.6mol/L。
(4)根据化学方程式可知,该反应的离子方程式是Al+4H++NO3-=Al3++2H2O+NO↑。根据方程式可知,铝元素的化合价从0价升高到+3价,失去3个电子。氮元素的化合价从+5价降低到+2价,得到3个电子,所以表示式是 。4.48LNO的物质的量是0.2mol,所以转移电子是0.6mol,被还原的硝酸是0.2mol,质量是0.2mol×63g/mol=12.6g。
。4.48LNO的物质的量是0.2mol,所以转移电子是0.6mol,被还原的硝酸是0.2mol,质量是0.2mol×63g/mol=12.6g。
考点:考查电解质的判断、溶液和胶体的区分、物质的量的有关计算、氧化还原反应方程式的判断以及表示等。
点评:在判断电解质和非电解质时,必需仅仅抓住化合物在溶液中或在熔融状态能否电离出阴阳离子,能电离出离子的化合物是电解质,否则是非电解质,而溶液导电只是一种现象,不能作为判断的依据。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 氧化物 | 电解质 | 非电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com