
分析 (1)①该反应中N元素化合价由+5价变为0价、S元素化合价由0价变为-2价、C元素化合价由0价变为+4价,得电子化合价降低的反应物是氧化剂;该反应中只有C是还原剂,根据方程式知,如果有0.5molS参加反应,则有1.5molC参加反应,根据C和转移电子之间关系式计算转移电子物质的量;
②酸性条件下,硝酸根离子具有强氧化性,能氧化Cu生成铜离子,自身被还原生成NO;
氯气具有强氧化性,能氧化硫化钾生成难溶性S单质;氯离子用硝酸酸化的硝酸银溶液检验,向溶液中加入少量硝酸酸化的硝酸银溶液,如果有白色沉淀生成说明有氯离子;
(2)高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分为氮气和氧气,另一种气体产物能使湿润的蓝色石蕊试纸变红,为氨气,根据原子守恒知还生成水蒸气;
(3)N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,阳离子结合氢氧根离子生成N4气体和水.
解答 解:(1)①该反应中N元素化合价由+5价变为0价、S元素化合价由0价变为-2价、C元素化合价由0价变为+4价,得电子化合价降低的反应物是氧化剂,所以KNO3和S是氧化剂;
该反应中只有C是还原剂,根据方程式知,如果有0.5molS参加反应,则有1.5molC参加反应,根据C和转移电子之间关系式得转移电子物质的量=1.5mol×(4-0)=6mol;
故答案为:KNO3和S;6;
②酸性条件下,硝酸根离子具有强氧化性,能氧化Cu生成铜离子,自身被还原生成NO,离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
氯气具有强氧化性,能氧化硫化钾生成难溶性S单质,所以溶液变浑浊;氯离子用硝酸酸化的硝酸银溶液检验,向溶液中加入少量硝酸酸化的硝酸银溶液,如果有白色沉淀生成说明有氯离子;
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;S;取少量溶液,加过量硝酸钡溶液,取上层清液,滴入硝酸酸化的硝酸银,若出现白色沉淀,证明有Cl-;
(2)高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分为氮气和氧气,另一种气体产物能使湿润的蓝色石蕊试纸变红,为氨气,根据原子守恒知还生成水蒸气,
反应方程式为:4NH4ClO4$\frac{\underline{\;碰撞\;}}{\;}$2N2↑+5O2↑+4HCl↑+6H2O,
故答案为:4NH4ClO4$\frac{\underline{\;碰撞\;}}{\;}$2N2↑+5O2↑+4HCl↑+6H2O;
(3)N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,阳离子结合氢氧根离子生成N4气体和水反应的离子方程式为N4H44++4OH-=N4↑+4H2O;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱反应生成能使湿润的红色石蕊试纸变蓝的气体为氨气,说明N4H4中含有NH4+,分析推断结构应为NH4N3,而与盐酸反应生成的产物之一具有极强烈的爆炸性,则钙化合物为HN3气体,依据原子守恒写出该产物爆炸的化学反应方程式为2HN3$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+3N2↑,
故答案为:N4H44++4OH-=N4↑+4H2O;2HN3$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+3N2↑.
点评 本题考查氧化还原反应有关计算、反应方程式的书写、离子检验等知识点,为高频考点,明确基本概念、各个物理量之间关系式、氯离子检验方法及实验现象是解本题关键,本题难点是判断反应中产物成分.


科目:高中化学 来源: 题型:选择题
| A. | 0.9375d | B. | 0.9685d | C. | 1.0655d | D. | 0.9135d |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| B. | 检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 | |
| C. | 向FeCl3溶液中滴加几滴KI溶液,振荡静置后分成两份,向其中一份溶液中加入淀粉,溶液呈蓝色;向另一份溶液中滴加KSCN溶液,溶液呈血红色.该实验说明FeCl3与KI反应有一定的限度 | |
| D. | 铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学是一门“中心的、实用的、创造性的”科学,在能源、资源的合理开发和安全应用方面有重要的作用 | |
| B. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| D. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 保持温度不变,再加0.2mol•L-1的HA溶液 | |
| B. | 保持浓度不变,升高温度 | |
| C. | 保持温度不变,加水 | |
| D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
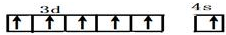 ,B在元素周期表的位置第二周期第ⅣA族
,B在元素周期表的位置第二周期第ⅣA族查看答案和解析>>
科目:高中化学 来源: 题型:填空题
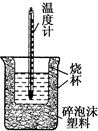 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com