
【题目】下列物质的分离方法的原理与溶解度不相关的是( )
A.蒸馏分馏
B.重结晶法
C.纸层析法
D.萃取分液
科目:高中化学 来源: 题型:
【题目】现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示。则X是( )

A. 水
B. 澄清石灰水
C. 纯碱溶液
D. 稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol/L醋酸溶液滴入10 mL1.0mol/LNaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是

A. n>1.0 B. a点Kw=1.0×10-14
C. 水的电离程度:c>b D. b点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代煤化工产生的H2S是一种重要的工业资源。请回答:
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:____________。硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:_______。己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=____。(结果取整数)
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节。实验装置如图:

已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是_________,当反应转移nmole-时,产生标准状况下的气休体积为__________________。
(3)H2S是煤化工原料气脱硫过程的重要中间体。反应原理为:
①COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS | H2 | H2O | CO | H2S | CO2 |
能量/kJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
计算表中x=____________。
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为_____________。平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为______,反应②的平衡常数为______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图,图2中轴表示实验时流入正极的电子的物质的量, y轴表示

A. 铜棒的质量 B. c(H+) C. c(SO42-) D. c(Zn2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
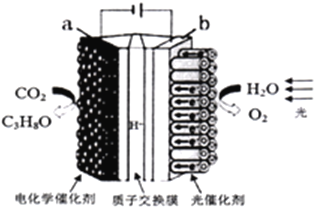
A. 该装置将化学能转化为光能和电能
B. a电极的反应为:3CO2+16H+-18e-=C3H8O+4H2O
C. 该装置工作时,H+从b极区向a极区迁移
D. 每生成1molO2有44gCO2被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol某烃完全燃烧生成0.4 mol H2O,生成CO2为0.8mol,则此有机物的分子式为______。若它是能聚合成高分子化合物的芳香族化合物,其结构简式为______;若其不能与氢气发生加成反应,则为__________,(提示立体结构)它的二氯代物有_______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com