
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T元素的离子结构示意图为__________。
(2)元素的非金属性(原子得电子的能力):Q ________W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该反应的化学方程式为_________________________________
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________________________其反应物的电子式为 。离子半径T3+__________R3-(填“>”、“<”、“=”)
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
【答案】(1)![]()
(2)弱于
(3)S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
(4)2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;![]() ;<
;<
(5)NaNO2
【解析】试题分析:由短周期元素及图可知,则Q、R在第二周期,T所处的周期序数与主族序数相等,则T在第三周期第ⅢA族,即T为Al,依次推出Q为C,R为N,W为S。
(1)T为Al,原子结构中有3个电子层,最外层电子数为3,其离子结构示意图为![]() 。
。
故答案为:![]() ;
;
(2)由硫酸的酸性大于碳酸的酸性可知,碳的非金属性弱于硫的非金属性。
故答案为:弱于;
(3)硫与浓硫酸在加热时发生氧化还原反应生成二氧化硫,反应为S+2H2SO4(浓)
![]() 3SO2↑+2H2O。
3SO2↑+2H2O。
故答案为:S+2H2SO4(浓)![]() 3SO2↑+2H2O;
3SO2↑+2H2O;
(4)R为N,原子序数比R多1的元素为O,其一种氢化物能分解为它的另一种氢化物,则反应为2H2O2![]() 2H2O+O2↑。过氧化氢的电子式为:
2H2O+O2↑。过氧化氢的电子式为:![]() ;电子层结构相同的离子原子序数大的半径小,T为Al、R为N,所以离子半径T3+<R3-。
;电子层结构相同的离子原子序数大的半径小,T为Al、R为N,所以离子半径T3+<R3-。
故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;![]() ;<;
;<;
(5)R有多种氧化物,其中甲的相对分子质量最小,则甲为NO,2L的甲气体与0.5L的
氧气相混合,得到等体积的NO和NO2,由氧化还原反应可知该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐中N元素的化合价为+3价,即化学式为NaNO2。
故答案为:NaNO2。


科目:高中化学 来源: 题型:
【题目】电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。


(1)电解NO制备NH4NO3原理如左图所示:
①阳极为_______ (填X或Y),Y的电极反应式为________________________________。
②为使电解产物完全转化为NH4NO3,需要补充的物质A的化学式为________________。
(2)用如图装置进行模拟电解NO2气体实验,可回收硝酸。
①电解时NO2发生反应的电极反应式_________________________________。
②若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为_________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是航空、军工、电力等领域的重要原料。工业上用钛酸亚铁(FeTiO3)冶炼钛(Ti)的过程是:①2FeTiO3+6C+7Cl2![]() 2TiCl4+2FeCl3+6CO
2TiCl4+2FeCl3+6CO
②在氩气环境中,2Mg+TiCl4![]() Ti+2MgCl2
Ti+2MgCl2
下列判断不正确的是( )
A.反应②属于置换反应
B.反应②中氯化物的总质量保持不变
C.反应①、②中钛元素的化合价都改变
D.反应②中,氩气只作为保护气并不参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.无论乙烯的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关
B.无论使用溴的四氯化碳溶液还是酸性KMnO4溶液都可以鉴别乙烯和乙烷
C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D.乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。回答下列问题:
(1) Y在元素周期表中的位置为_____________________________.
(2) 上述元素的最高价氧化物对应的水化物酸性最强的是_____________________ (写化学式),非金属气态氢化物还原性最强的是_________________(写化学式)。
(3) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有__________________ (写出其中两种物质的化学式))。
(4) ZX的电子式为_________________;ZX与水反应放出气体的化学方程式为_____________。
(5) 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),放电时,电池的正极反应
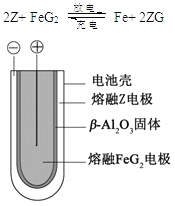
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用下图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
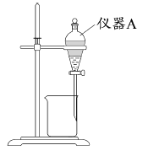
①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素, 它们的原子序数依次增大。 已知A和B原子具有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍, C是该周期中原子半径最大的元素, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物,E与D相邻。 试根据以上叙述回答:
(1)元素名称: A C __________ E
(2)写出AB2与过量氢氧化钠溶液反应的离子方程式 ;写出 C2B2与AB2反应的化学方程式 ;
(3)画出D的原子结构示意图 ,用电子式表示化合物 C2D 的形成过程 ;
(4)D、E的气态氢化物的稳定性 大于 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据一定的标准采取不同的分类方法是人们认识事物常用的方法。下列有关物质类别的判别标准中正确的是( )
A.酸:能否与金属反应放出氢气
B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键
D.酸性氧化物:能否与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )
![]()
A. 原子半径Z<M
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第二周期、第ⅥA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com