
| A、在常温常压下,14 gN2含有的分子数为0.5NA |
| B、50 mL1 mol/L的Na2SO4溶液中含Na+数为NA |
| C、标准状况下,22.4 L H2和O2的混合气体所含分子数为NA |
| D、24 g Mg与盐酸充分反应转移电子数为NA |
| 14g |
| 28g/mol |


科目:高中化学 来源: 题型:
 如图表示反应X(g)?4Y(g)+Z(g),△H<O,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
如图表示反应X(g)?4Y(g)+Z(g),△H<O,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )| A、第6min后,反应就终止了 |
| B、X的平衡转化率为85% |
| C、第1-5min内,X的平均反应速率为0.1mol/(L?s) |
| D、第6-8min内,各物质的浓度之比为1:4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol/(L?min) |
| B、0.1 mol/(L?min) |
| C、0.2 mol/(L?min) |
| D、0.3 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2CO3、HCl、CaCl2 |
| B、Na2CO3、HNO3、MgSO4 |
| C、Na2CO3、HCl、Ba(NO3)2 |
| D、H2SO4、Na2CO3、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO
| ||
| B、用硫酸铜溶液除去乙炔中的硫化氢气体:Cu2++S2-=CuS↓ | ||
C、乙酸与碳酸钙溶液反应:2CH3COOH+CO
| ||
| D、酸性高锰酸钾溶液中通入乙炔后紫色褪去:2MnO4-+6H++C2H2=2Mn2++2CO2+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
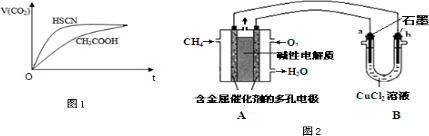
查看答案和解析>>
科目:高中化学 来源: 题型:
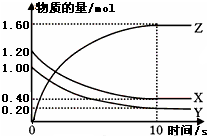 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com